59-я Московская олимпиада школьников по химии
Задачи теоретического тура (8 класс)
Условия задач
8-1. Каждая приведенная ниже
фраза имеет только одно правильное окончание. Укажите его.
1.
Дальтонизм, это: а) научная школа; б) точка зрения; в) болезнь; г) философское
учение.
2.
Первым философский камень получил: а) Демокрит; б) Аристотель; в) Карл Маркс;
г) никто.
3.
Масса покоя атома - величина а) относительная; б) абсолютная; в) периодическая;
г) мнимая.
4.
Д.И. Менделеев писал: <Периодическому закону будущее не грозит: а) разрушением;
б) покушением; в) предвкушением; г) развитием>.
5.
Автор известной модели атома носил фамилию: а) Литий; б) Бериллий; в) Бор; г)
Углерод.
6.
Ломоносов открыл закон: а) Кулона; б) исключенного третьего; в) сохранения
массы; г) о всеобщей воинской обязанности.
7.
Больше всего в воздухе содержится: а) азота; б) кислорода; в) озона; г)
углекислого газа.
8. 1
моль вещества занимает объем а) 1 л; б) 22.4 л; в) 6×1023 л; г) неизвестно какой.
9. В
эндотермической реакции: а) кончается температура; б) поглощается температура;
в) поглощается тепло; г) температуру записывают в конце уравнения.
10. Отношение массы части к массе целого есть: а) массовая
доля; б) целая доля; в) тяжелая доля; г) тяжелая женская доля.
8-2. Гомеопатия - раздел
медицины, использующий для лечения очень малые дозы и концентрации веществ.
Малые концентрации получают путем последовательного разведения. Вещество
разбавляют в 10 (децимальное разбавление) или 100 (сотое разбавление) раз, то
что получилось - еще во столько же раз и т.д. Знак означает, что вещество три
раза разбавляли в 10 раз, C3 - 3 раза в 100 раз.
А.
Гранула препарата мышьяка C6, весит 75 мг. Сколько
атомов мышьяка ней находится?
Б.
Сколько (примерно) сотых разведений необходимо сделать, чтобы в 1 литре
раствора не содержалось ни одной молекулы растворенного вещества?
В.
Почему в гомеопатических препаратах часто можно встретить обозначение и
<С6>, но никогда - ?
8-3. У Вас в распоряжении имеются
вода и оксид серы (VI). Воспользуйтесь еще одним дополнительным веществом
(по Вашему усмотрению) и запишите уравнения реакций получения из них как можно
большего количества новых веществ. Можно использовать как исходные вещества,
так и продукты их превращения, а также любое лабораторное оборудование.
8-4. При 100°С
в 100 г воды растворяется 347 г NaOH.
А.
Какова массовая доля NaOH в полученном растворе?
Б.
Какова мольная доля NaOH в полученном растворе?
В.
Сколько молекул воды приходится на 1 атом (точнее, ион) натрия в полученном
растворе?
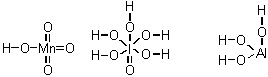
8-5. Можно сказать, что
гидроксиды - соединения, состоящие из трех элементов, содержащие водород и
кислород, причем водород в них связан только с кислородом, а связь О-О
отсутсвует. Нарисуйте графические формулы гидроксидов:
А. Марганца
(VII) при условии, что он содержит только 1 атом водорода и 1 атом
марганца.
Б.
Иода (VII) при условии, что единственный атом иода окружен 6-ю атомами
кислорода.
В.
Алюминия при условии, что в нем только 1 атом алюминия и нет ни одной двойной
связи.
8-6. Чтобы ракетное топливо
горело без воздуха, в него входит два компонента: горючее и окислитель. Их
соотношение таково, что Объем газообразных (при температуре пламени) продуктов
сгорания в расчете на массу топлива должен быть возможно большим. Рассчитайте
объем (приведенный к н.у.) продуктов сгорания 100 г смеси NH4NO3 и (СN3H6)NO3, считая воду паром. В какую
сторону изменится объем газов при температуре пламени (давление атмосферное)?
Соотношение компонентов смеси таково, что при ее горении весь азот превращается
в N2,
водород - в H2O а углерод - в СO2.
Решения
8-1. 1-в, 2-г, 3-б, 4-а, 5-в,
6-в, 7-а, 8-г, 9-в, 10-а.
8-2. А. В этой грануле
содержится (75/1000)×100-6 = 7,5×10-14 г мышьяка
Это соответствует 7,5×10-14(г)/75(г/моль)
= 10-15(моль).
В таком количестве содержится 10-15×6×1023 = 6×108 (шт).
Б. В 1 л воды содержится (1000/18)×6×1023 = 7,5×1025 молекул.
Соответственно, чтобы в 1 л раствора не было ни одной молекулы, 1 молекула
растворенного вещества должна приходиться больше, чем на 7,5×1025 молекул
воды. Если пренебречь разницей молекулярных масс воды и растворенного вещества,
то растворенное вещество нужно разбавить примерно в 1026 раз, что
означает разбавление С13.
В. Потому что D6, это то же самое, что C3, а
разводить трижды в 100 раз технически проще, чем 6 раз в 10.
8-3. Если вещество получено по не идущей реакции, вещества, полученные
из него не засчитываются.
8-4. А. 347/(347+100) = 0.78.
Б. 347 г NaOH соответствует 347/40 = 8.7
моль.
100 г воды соответствует 100/18 = 5.6 моль.
Следовательно, мольная доля NaOHсоставит
8.7/(8.7+5.6) = 0.61
В. На 1 моль натрия приходится менее 5.6/8.7
= 0.64 моль воды (см. задание Б). Молекулярное соотношение такое же.
8-5.
8-6. 2NH4NO3
+ (CH6N3)NO3 = CO2 + 7H2O
+ 4N2
Так
как, по условию, все продукты сгорания газообразны, их масса тоже равна 100 г.
Рассчитаем количество газа в этой смеси. Примем количество CO2 за x. Тогда
44x + 18x×7 + 28x×4 = 100
282x = 100.
x = 0,355 моль.
Общее
количество газов составит 0,355×(1+7+4) = 5,28 моль.
Объем
такой смеси - 5,28×22,4 = 95,3 л.
При
температуре пламени объем будет больше, так как при нагревании газы
расширяются.
59-я Московская олимпиада школьников по химии