ОТВЕТЫ И УКАЗАНИЯ
Задача 1
1.1. Наибольшая длина волны
соответствует наименьшей разности энергий, т.е.
переходу n = 2 ![]() n = 3. Для He+
(заряд ядра +2)
n = 3. Для He+
(заряд ядра +2)
![]() ,
, ![]() =
164.11 нм.
=
164.11 нм.
1.2.![]()
E = –hcRH = –13.6 эВ.
1.3.Энергия в данной модели прямо пропорциональна массе, а радиус обратно пропорционален массе:
энергия основного состояния мюония = –207 ![]() 13.6 = –2.82 кЭв;
13.6 = –2.82 кЭв;
радиус первой боровской орбиты мюония = 0.53 / 207 =
2.6 ![]() 10–3 Е.
10–3 Е.
1.4 Вероятность = [![]() (a0)] 2 4
(a0)] 2 4![]() a02
a02 ![]() 0.001 a0 = 0.004 e–2 = 5.41
0.001 a0 = 0.004 e–2 = 5.41 ![]() 10–4.
10–4.
1.5 Мелкая кривая – первый канал (диссоциация на атомы), глубокая кривая – второй канал (диссоциация на ионы).
1.6 Первый канал: De = 2![]() (–13.6) – (–31.9) = 4.7 эВ.
(–13.6) – (–31.9) = 4.7 эВ.
Второй канал: De = (–14.3) – (–31.9) = 17.6 эВ.
1.7.Сродство к электрону: E(H) – E(H–) = –13.6 – (–14.3) = 0.7 эВ.
1.8 Энергия каждого электрона в H- равна 13.6 Zeff2.
Для вылета обоих электронов требуется 14.3 эВ:
2![]() 13.6 Zeff2 = 14.3,
откуда Zeff = 0.73.
13.6 Zeff2 = 14.3,
откуда Zeff = 0.73.
33 МХО Задача 2
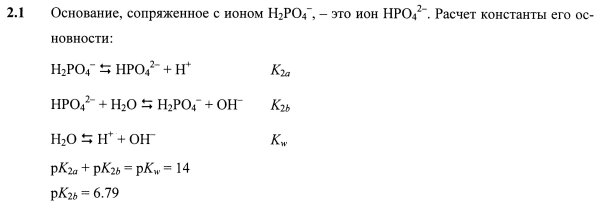
2.2.
2.3 Обозначим PO4 = X и мольные доли
фосфоросодержащих частиц: f0 = [H3X] /
C, f1 = [H2X–] / C, f2
= [HX2–] / C, f3 = [X3–] / C,
где C = 1.00![]() 10–3 M –
исходная концентрация фосфорной кислоты: f0
+ f1 + f2 + f3 = 1.
10–3 M –
исходная концентрация фосфорной кислоты: f0
+ f1 + f2 + f3 = 1.
K1a = [H2X–] [H+] / [H3X] = [H+] f1 / f0.
K2a = [HX2–] [H+] / [H2X–] = [H+] f2 / f1.
K3a = [X3–] [H+] / [HX2–] = [H+] f3 / f2.
Из этих уравнений можно выразить мольные доли:
f0 = [H+]3 / D, f1 = [H+]2 K1a / D, f2 = [H+] K1a K2a / D, f3 = K1a K2a K3a / D, где
D = K1a K2a K3a + K1a K2a [H+] + K1a [H+]2 + [H+]3.
Из значений pK и pH следует: K1a =
7.59![]() 10–3, K2a = 6.17
10–3, K2a = 6.17![]() 10–8, K3a = 4.79
10–8, K3a = 4.79![]() 10–13, [H+] = 10–7.
Отсюда мольные доли фосфоросодержащих частиц
при pH = 7:
10–13, [H+] = 10–7.
Отсюда мольные доли фосфоросодержащих частиц
при pH = 7:
H3PO4: f0 = 8.10![]() 10–6,
10–6,
H2PO4–: f1 = 0.618,
HPO42–: f2 = 0.382,
PO43–: f3 = 1.83![]() 10–6.
10–6.
2.4 Пусть S – молярная концентрация
фосфата цинка в воде, тогда [Zn2+] = 3S,
общая концентрация фосфоросодержащих частиц – 2S,
а [PO43–] = f3![]() 2S
(f3 = 1.83
2S
(f3 = 1.83![]() 10–6).
10–6).
ПР = 9.1![]() 10–33 = [Zn2+]3
[PO43–]2 = (3S)3 (f3
10–33 = [Zn2+]3
[PO43–]2 = (3S)3 (f3![]() 2S)2, откуда S = 3.0
2S)2, откуда S = 3.0![]() 10–5.
10–5.
[Zn2+] = 9.0![]() 10–5,
10–5,
[PO43–] = 1.1![]() 10–10.
10–10.
33 МХО Задача 3
3.1.При расширении энтропия газа увеличивается, а энтропия окружающей среды уменьшается, т.к. газ при расширении забирает теплоту из окружения. Правильный ответ (в).
3.2 ![]() Sсис = nR ln(V2/V1)
= 27.4 Дж/К.
Sсис = nR ln(V2/V1)
= 27.4 Дж/К.
3.3 Q = P ![]() V = 100
V = 100 ![]() 20 = 2000 Дж.
20 = 2000 Дж. ![]() Sокр = –Q / T
= –2000 / 288 = –6.94 Дж/К.
Sокр = –Q / T
= –2000 / 288 = –6.94 Дж/К.
3.4 ![]() Sвсел =
Sвсел = ![]() Sсис
+
Sсис
+ ![]() Sокр = 20.5 Дж/К.
Положительное изменение энтропии находится в
согласии со Вторым законом термодинамики.
Sокр = 20.5 Дж/К.
Положительное изменение энтропии находится в
согласии со Вторым законом термодинамики.
3.5 Правильный ответ – (б).
3.6 Правильный ответ – (а).
3.7.Следствие из уравнения
Клапейрона-Клаузиуса: ln(P2/P1) = ![]() Hсубл / R
Hсубл / R ![]() (1/T1 – 1/T2), P2
= 5.18 бар, P1 = 1.01 бар, T2 = 273.15 – 56.6,
T1 = 273.15 – 78.5.
(1/T1 – 1/T2), P2
= 5.18 бар, P1 = 1.01 бар, T2 = 273.15 – 56.6,
T1 = 273.15 – 78.5. ![]() Hсубл
= 26.1 кДж/моль.
Hсубл
= 26.1 кДж/моль.
3.8 CO2(г) + С(тв) = 2CO(г).
![]() rHo = 2
rHo = 2![]() (- 110.53) - (- 393.51) = 172.45 кДж;
(- 110.53) - (- 393.51) = 172.45 кДж;
![]() rSo = 2
rSo = 2![]() (197.66) - 213.79 - 5.74 = 175.79 Дж/К;
(197.66) - 213.79 - 5.74 = 175.79 Дж/К;
![]() rGo =
rGo = ![]() rHo - T
rHo - T![]() rSo = 120.06 кДж;
rSo = 120.06 кДж;
![]() rGo > 0. KP
= exp(-
rGo > 0. KP
= exp(- ![]() rGo/RT) <
1.
rGo/RT) <
1.
3.9 KP = 1, ![]() rGo
= 0.
rGo
= 0.
T = ![]() rHo /
rHo / ![]() rSo = 980 К.
rSo = 980 К.
3.10. P(CO) = x, P(CO2) = 5.0 - x.
KP = 10.0 = x2 / (5.0 - x).
x = P(CO) = 3.7 бар.
33 МХО Задача 4
4.1.Пусть N0 – исходное число атомов тория-232, N – их число в настоящий момент, тогда образовалось N0 – N атомов свинца-208.
N = N0 exp(–0.693t / t1/2).
(N0 – N) / N = 0.104
exp(0.693t / 1.41![]() 1010) = 1.104
1010) = 1.104
t = 2.01![]() 109 лет.
109 лет.
4.2 206Pb/238U = exp(–0.693t / t1/2)
– 1 = exp(0.693![]() 2.01
2.01![]() 109
/ 4.47
109
/ 4.47![]() 109) – 1 = 0.366.
109) – 1 = 0.366.
4.3 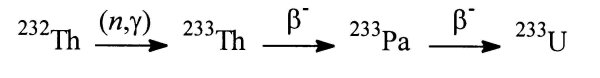
4.4 1) 14.6 мин – период полураспада 101Mo,
поэтому число атомов 101Mo равно:
N1 = N0 / 2 = 25000.
2) В системе последовательных реакций первого
порядка число атомов промежуточного вещества 101Tc
дается выражением:, 
3) Число атомов 101Ru при t = 14.6 мин:
N3 = N0 – N1 – N2 = 7900.
Тексты задач и ответов подготовил к публикации доцент химического факультета МГУ В.В.Еремин.