|
Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по химии - 2004 г.
ДЕВЯТЫЙ КЛАСС
(Решения)
Задача 9-1 (автор А. И. Жиров)
1. Масса моля "селитреного газа" по Кирвану
1,19  29 = 34,5; а по Дэви 1,102 29 = 34,5; а по Дэви 1,102  29 = 32. Наиболее близкое значение из
оксидов азота имеет NO (30). 29 = 32. Наиболее близкое значение из
оксидов азота имеет NO (30).
2. Ошибка у Кирвана составляет(34,5 - 30)/30 = 0,15 (15%), у
Дэви (32 - 30)/30 = 0,067 (6,7%).
3. 4NO = N2 + 2NO2 (N2O4)
4. 6NO + 4NH3 = 5N2 + 6H2O
После конденсации паров воды объем газовой смеси
уменьшается вдвое.
5. Содержание азота в NO составляет 14 : 30 = 0,467 (46,7%),
кислорода -53,3%. Погрешность по азоту (46,7 - 42) : 46,7 =
0,101 (10,1%); по кислороду - (58 - 53,3) : 53,3 = 0,088 (8,8%).
6.4NH3 + 15MnO2 = 5Mn3O4 + 4NO + 6H2O
7. Образование NO возможно при восстановлении
соединений с более высокими положительными
степенями окисления азота : 2KNO2 + 2KI + 2H2SO4
= I2 + 2NO + 2H2O
и окислении соединений с более низкими степенями
окисления азота: 4NH3 + 5O2 = 4NO + 6H2O
8. 1) NO; 2) N2O; 3) NO2; 4) NO3 4) N2O3
Задача 9-2 (автор Ю. Н. Медведев)
1. Поскольку объем газовой смеси 1500 мл, то V(NO)
= 0,39 л, V(N2O) = 0,21 л, объём неизвестного
компонента V(Y) = 0,40 л. Для удобства составим
табличку:
| газ |
М, г/моль |

|
V(газа), л |
m, г |
| NO |
30 |
0,39 |
0,585 |
(0,585/22,4)•30 = 0,7835 |
| N2O |
44 |
0,21 |
0,315 |
(0,315/22,4)•44 = 0,6188 |
| Y |
y |
0,40 |
0,6 |
(0,6/22,4)•у = 0,0268у |
Используя значение массовой доли NO, запишем:
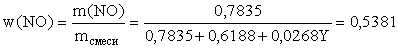
откуда y = 2 г/моль, что отвечает молярной массе
только одного газа – водорода Н2.
Массовая доля w(H2) = 0,0268•2/(0,0268•2+0,7835+0,6188)
= 3,68%
2. = Mсм/Vm =
(0,39•30+0,21•44+0,4•2)/22,4 = 0,97 г/л = Mсм/Vm =
(0,39•30+0,21•44+0,4•2)/22,4 = 0,97 г/л
3. По закону эквивалентов,  экв(Ме) = экв(Ме) =  экв(H2)
+ экв(H2)
+  экв(NO)
+ экв(NO)
+  экв(N2O)
= (0,6/22,4)•2 + (0,585/22,4)•3 + (0,315/22,4)•8 = 0,0536 + 0,0784 + 0,113 = 0,245
моль. Тогда молярная масса эквивалента
неизвестного металла равна Мэкв(Ме) = m/ экв(N2O)
= (0,6/22,4)•2 + (0,585/22,4)•3 + (0,315/22,4)•8 = 0,0536 + 0,0784 + 0,113 = 0,245
моль. Тогда молярная масса эквивалента
неизвестного металла равна Мэкв(Ме) = m/ экв
= 6,714/0,245 = 27,4 г/моль, что отвечает двухвалентному
марганцу: М(Ме) = 2•27,4 = 54,8 г/моль = М(Mn). экв
= 6,714/0,245 = 27,4 г/моль, что отвечает двухвалентному
марганцу: М(Ме) = 2•27,4 = 54,8 г/моль = М(Mn).
4. Mn + 2,440 HNO3 > Mn(NO3)2 + 0,220 H2
+ 0,210 NO + 0,115 N2O + H2O
5. 2NO + 2H2  2H2O + N2 2H2O + N2
N2O + H2  H2O + N2 H2O + N2
2N2O  2N2 + O2 2N2 + O2
Задача 9-3. (автор А. И. Жиров)
1. Масса минерала II, выделенного в
результате кристаллизации, больше массы взятого
термонатрита, следовательно, может
кристаллизоваться кристаллогидрат с большим
количеством воды.
Масса раствора, оставшегося после
кристаллизации равна 100 +45 -65,35 = 79,65 (г). Масса
соляной кислоты 25  1,18 = 29,5 (г).
Количество хлороводорода составляет 29,5 1,18 = 29,5 (г).
Количество хлороводорода составляет 29,5  1,18 1,18  0,36 : 36,45 = 0,29 (моль).
Уменьшение массы при добавление соляной кислоты
равно: 79,65 + 29,5 - 103,23 = 5,92 (г), может быть обусловлено
газовыделением, тогда растворимый минерал был
карбонатом щелочного металла. 0,36 : 36,45 = 0,29 (моль).
Уменьшение массы при добавление соляной кислоты
равно: 79,65 + 29,5 - 103,23 = 5,92 (г), может быть обусловлено
газовыделением, тогда растворимый минерал был
карбонатом щелочного металла.
CO22- + 2H+®
CO2 + H2O
Количество выделившегося углекислого газа
составляет 5,92 : 44 = 0,1345 (моль). Соляная кислота была
взята в избытке. В таком случае минерал III -
хлорид щелочного металла, его количество
составляет 0,1345  2 = 0,269 (моль). Тогда атомная масса
щелочного металла будет равна 15,72 : 0,269 -35,45 = 23, что
соответствует натрию. Минерал III - NaCl (галит,
каменная соль). 2 = 0,269 (моль). Тогда атомная масса
щелочного металла будет равна 15,72 : 0,269 -35,45 = 23, что
соответствует натрию. Минерал III - NaCl (галит,
каменная соль).
Термонатрит- Na2CO3 xH2O (x xH2O (x  0), III - Na2CO3 0), III - Na2CO3 yH2O
(y >x). yH2O
(y >x).
Из баланса количества карбоната натрия следует:
45/(106 + 18x) = 65,35/(106 + 18y) - 0,1345 или
553y = 3668 + 1433x + 43,6xy
При x = 0, y = 6,6 ( не целочисленное значение)
x = 1, y = 10 , таким образом термонатрит - Na2CO3 H2O, II
- Na2CO3 H2O, II
- Na2CO3 10H2O (сода). 10H2O (сода).
2. Сода, галит (каменная соль).
3. Na2CO3 H2O: моль термонатрита был
растворен в 124 : 5,44 H2O: моль термонатрита был
растворен в 124 : 5,44  100 = 2279 (г) воды, масса раствора 2279 +
124 = 2403 (г). Выделившаяся теплота при растворении
составляет 2403 100 = 2279 (г) воды, масса раствора 2279 +
124 = 2403 (г). Выделившаяся теплота при растворении
составляет 2403  4,18 4,18  1,05 = 10549 (Дж). Тепловой эффект
растворения составляет 10,5 кДж/моль. 1,05 = 10549 (Дж). Тепловой эффект
растворения составляет 10,5 кДж/моль.
Na2CO3 10H2O: моль соды был растворен
в 286 : 3,97 10H2O: моль соды был растворен
в 286 : 3,97  200 = 14408 (г) воды, масса раствора 14408 +
286 = 14694 (г). При растворении моль соды поглощается
14694 200 = 14408 (г) воды, масса раствора 14408 +
286 = 14694 (г). При растворении моль соды поглощается
14694  4,18 4,18 1,08 = 66334
(Дж) теплоты. Тепловой эффект растворения
составляет 66,3 (кДж/моль). 1,08 = 66334
(Дж) теплоты. Тепловой эффект растворения
составляет 66,3 (кДж/моль).
NaCl: моль галита был растворен в 58,45 : 3,24  200 = 3608 (г)
воды, масса раствора составила 3608 + 58,45 = 3666 (г).
Теплоты в процессе растворения поглощается 3666 200 = 3608 (г)
воды, масса раствора составила 3608 + 58,45 = 3666 (г).
Теплоты в процессе растворения поглощается 3666  4,18 4,18  0,34 = 5210
(Дж) теплоты. Тепловой эффект растворения 5,2
(кДж/моль). 0,34 = 5210
(Дж) теплоты. Тепловой эффект растворения 5,2
(кДж/моль).
4. При нагревании происходит дегидратация
декагидрата:
Na2CO3 10H2O ® Na2CO3 10H2O ® Na2CO3 H2O +
9H2O H2O +
9H2O
По закону Гесса тепловой эффект данной реакции
будет равен алгебраической разности теплот
растворения (с учетом знака процесса) 66,3 - (-10,5) = 76,8
(кДж/моль). Столько теплоты поглотится при
дегидратации 1 моль декагидрата с образованием
моногидрата. Потеря массы составит (9  18) : 286 =
0,5664 (56,64%). 18) : 286 =
0,5664 (56,64%).
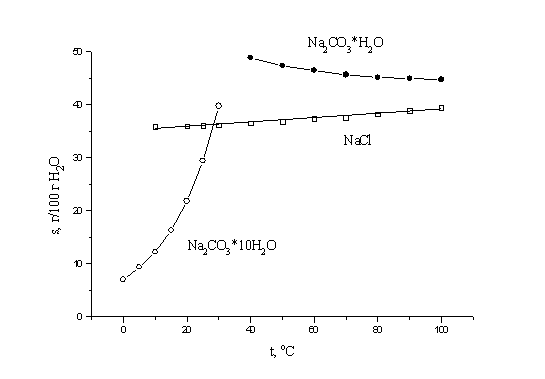
5. Растворимость - равновесие между твердой
растворяемой солью и раствором. Тогда, по
принципу Ле-Шателье, для процессов растворения
солей, сопровождающихся экзотермическим
эффектом, растворимость будет понижаться при
повышении температуры, а для эндотермического
растворения - увеличиваться. Причем, абсолютная
величина теплового эффекта (по модулю)
свидетельствует насколько существенно зависит
растворимость от температуры. Таким образом,
растворимость десятиводного карбоната натрия
будет значительно увеличиваться при повышении
температуры; растворимость хлорида натрия будет
очень незначительно увеличиваться при повышении
температуры, а растворимость моногидрата
карбоната натрия будет уменьшаться при
повышении температуры.
6. Натрию (в английском языке он так и называется
sodium).
Задача 9-4. (автор А. И. Жиров)
1. Масса "моля" газообразных продуктов
имеет массу 1,38  29 = 40 (г). В продуктах разложения
мог находиться CO2 с другим, более легким
газом. 29 = 40 (г). В продуктах разложения
мог находиться CO2 с другим, более легким
газом.
Полученное вещество является окислителем
(способно окислять иодид-ион в кислой среде).
Попробуем рассчитать значение молярной массы,
приходящейся на моль электронов в
окислительно-восстановительной реакции:
2S2O32- -2e = S4O62-
Тиосульфат-ион является одноэлектронным
восстановителем, тогда молярная масса вещества,
приходящаяся на 1 моль электронов окислителя
будет равна 0,1000: 1,01 10-3 = 99 г ( это значение даже
немного меньше массы моля KHCO3). В случае
двухэлектронного окислителя масса моля
составляет 198 (г). 10-3 = 99 г ( это значение даже
немного меньше массы моля KHCO3). В случае
двухэлектронного окислителя масса моля
составляет 198 (г).
Масса выделяющихся продуктов реакции составит 198
 0,303 = 60
(г). Тогда на моль CO2 в смеси может
находиться еще 16 г - 1/2 моль кислорода. Твердый
остаток 198 - 60 = 138 (г), что соответствует карбонату
калия. Реакция разложения имеет вид: 0,303 = 60
(г). Тогда на моль CO2 в смеси может
находиться еще 16 г - 1/2 моль кислорода. Твердый
остаток 198 - 60 = 138 (г), что соответствует карбонату
калия. Реакция разложения имеет вид:
K2C2O6 = K2CO3
+ CO2 + 1/2O2или
2K2C2O6 = 2K2CO3 + 2CO2
+ O2
2.2KHCO3 = K2C2O6 + H2
2K2C2O6 = 2K2CO3 + 2CO2
+ O2
K2C2O6 + 2KI + 2H2SO4
= 2K2SO4 + I2 + 2CO2
+ 2H2O
I2 + 2Na2S2O3 = Na2S4O6
+ 2NaI
3.K2C2O6 + H2SO4 = K2SO4
+ 2CO2 + H2O2
4. Растворимость гидрокарбоната калия гораздо
больше, чем растворимость гидрокарбоната натрия,
а, по-видимому, растворимость пероксодикарбоната
калия меньше растворимости пероксодикарбоната
натрия.
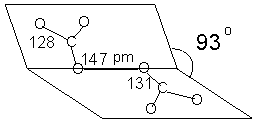
5. Соединение ионное: K+, C2O62-.
Строение иона C2O62-:
6. Наиболее близким по способу получения и
свойствам является пероксодисульфат калия:
2KHSO4 = K2S2O8 + H2 (электролиз водного раствора
гидросульфата калия при охлаждении)
K2S2O8 + 2KI = 2K2SO4 + I2
(является сильным двухэлектронным окислителем в
водных растворах)
Способ получения, свойства и строение K2C2O6
были представлены в работе:
R. E. Dinnerbier, S. Vensky, P. W. Stephens, M. Jansen, Angew. Chem., Int. Ed.
Engl., 41 (11) 1902-1924 (2002). "Crystal Structure of K2C2O6
- First Proof of Existence and Constitution of a Peroxodicarbonate Ions."
Задача 9-5. (автор А. И. Жиров)
1. Полученное вещество - кислородсодержащая
кислота (как минимум двухосновная). Силу кислоты
можно оценить по переходам индикаторов. По
первой стадии это кислота средней силы (рКа
< 4,2), по второй слабая (рКа < 8). Тогда
общей формулой (по правилу Полинга) для такой
кислоты будет (HO)2ЭO, где под "Э" может
скрываться не только элемент, но и еще одна
группа (OH). Из результатов титрования можно
рассчитать молярную массу кислоты: 0,5986 : 7,3 10-3 =
82 (г). Тогда на долю "Э" приходится 82 - 17 10-3 =
82 (г). Тогда на долю "Э" приходится 82 - 17  2 - 16 = 32,
но "Э" не может быть серой, т. к. полученное
вещество твердое. Тогда наиболее вероятный
вариант - "Э" = PH. Состав кислоты: (HO)2HPO
или H3PO3 - фосфористая кислота. 2 - 16 = 32,
но "Э" не может быть серой, т. к. полученное
вещество твердое. Тогда наиболее вероятный
вариант - "Э" = PH. Состав кислоты: (HO)2HPO
или H3PO3 - фосфористая кислота.
2. Графическая формула:
Строение (координационное окружение фосфора ) 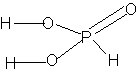 - искаженный
тетраэдр: - искаженный
тетраэдр: 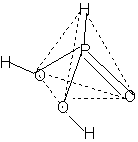
3. Реакция синтеза (гидролиз трихлорида фосфора): PCl3 + 3H2O
= H3PO3 + 3HCl
4. Исходная бесцветная жидкость может быть получена из фосфора (эта модификация
имеет название "белого фосфора", но окраска у нее желтоватая) и хлора:
2P + 3Cl2 = 2PCl3
5. Реакции фосфористой кислоты и фосфитов:
H3PO3 + NaOH = NaH2PO3
+ H2O
H3PO3 + 2NaOH = Na2HPO3 + 2H2O
Na2HPO3 + BaCl2 = BaHPO3 + 2NaCl + 2NaCl
Na2HPO3 + 2 AgNO3 = Ag2HPO3 + 2NaNO3 (белыйосадок) + 2NaNO3 (белыйосадок)
Ag2HPO3 + H2O = 2Ag + H3PO4
(темнеющий со временем)
Задача 9-6 (автор А. И. Жиров)
1. а) средние соли (по составу): K2SO4, K2S2O7,
K2CO3, K2P2O7, K2SO3,
K2S2O5, K2S.
б) кислые (по составу) соли: KHSO4, KHCO3, KH2PO4,
K2HPO4, KHS.
2. а) нейтральные растворы: K2SO4.
б) щелочные растворы: K2CO3, KHCO3, K2HPO4,
K4P2O7, K2SO3, K2S,
KHS.
в) кислыерастворы: KHSO4, K2S2O7,
KH2PO4, K2S2O5.
3. CO32- + H2O 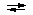 HCO3- + OH- HCO3- + OH-
HCO3- + H2O 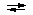 H2CO3
+ OH- H2CO3
+ OH-
HPO42- + H2O 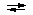 H2PO4- + OH- H2PO4- + OH-
P2O74- + H2O 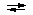 HP2O73- + OH- HP2O73- + OH-
SO32- + H2O 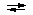 HSO3-
+ OH- HSO3-
+ OH-
S2- + H2O 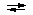 HS-
+ OH- HS-
+ OH-
HS- + H2O 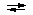 H2S
+ OH- H2S
+ OH-
HSO4- + H2O 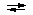 SO42-
+ H3O+ SO42-
+ H3O+
S2O72- + H2O = 2HSO4-
H2PO4- + H2O 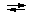 HPO42-
+ H3O+ HPO42-
+ H3O+
S2O52- + H2O 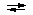 2HSO3- 2HSO3-
HSO3- + H2O 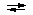 SO32-
+ H3O+ SO32-
+ H3O+
4. При растворении в воде пиросульфат калия
полностью превращается в гидросульфат: S2O72-
+ H2O = 2HSO4- его водный раствор
можно рассматривать как 2М раствор KHSO4.
Тогда при добавлении раствора KHSO4 к
раствору карбоната калия будет протекать
реакция (при избытке карбоната): CO32-
+ HSO4- = HCO3- + SO42-
Масса образующегося раствора равно 110 + 55 = 165 (г). В
растворе (объемом 150 мл) будут находиться: 0,1 моль
HCO3- (0,1 : 0,15 = 0,67 M), 0,1 моль SO42-
(0,67 M); 0,3 моль K+ (2 M).
При обратном порядке смешивания ( раствор
карбоната калия добавляется к гидросульфату )
будет происходить реакция:
2HSO4- + CO32- = CO2 + H2O + 2SO42-
Выделится 0,05 моль CO2, масса полученного
раствора составит 165 -2,2 = 162,8 (г). Концентрация
раствора: 0,05 :0,15 = 0,33 М CO32-; 0,67 M SO42-;
2 M K+.
5. K2SO4 + BaCl2 = BaSO4 + 2KCl + 2KCl
KHSO4 + BaCl2 = BaSO4 + KCl + HCl + KCl + HCl
K2S2O7 + H2O + 2BaCl2
= 2BaSO4 + 2KCl + 2HCl + 2KCl + 2HCl
K2CO3 + BaCl2 = BaCO3 + 2KCl + 2KCl
2KHCO3 + BaCl2 = BaCO3 + 2KCl + H2O + CO2 + 2KCl + H2O + CO2
K2HPO4 + BaCl2 = BaHPO4 + 2KCl + 2KCl
6. K2SO4 + H2SO4 = 2KHSO4
(в водном растворе, с последующей кристаллизацией)
2KHSO4 = K2S2O7 + H2O (при нагревании расплава)
KHSO4 + KHCO3 = K2SO4 + H2O
+ CO2 (в водном растворе)
K2S2O7 + H2O = 2KHSO4
(в водном растворе)
K2CO3 + CO2 + H2O = 2KHCO3
(в водном растворе)
2KHCO3 = K2CO3 + H2O + CO2(в
водном растворе выше 60о или твердый выше 150о)
K2HPO4 + H3PO4 = 2KH2PO4
(в водном растворе)
KH2PO4 + KOH = K2HPO4 + H2O
(в водном растворе)
2K2HPO4 = K4P2O7 + H2O (нагревание соли выше 300о)
K4P2O7 + H2O = 2K2HPO4
(кипячение водного раствора, катализатор - кислота)
|


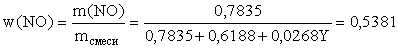


 - искаженный
тетраэдр:
- искаженный
тетраэдр: 