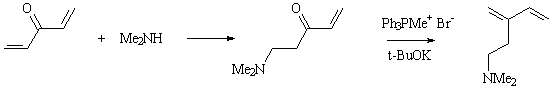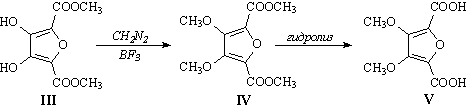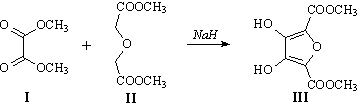Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по
химии - 2004 года
РЕШЕНИЯ "ЗАДАЧ ПО ВЫБОРУ"
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Задача 1 (автор А. И. Жиров)
1. n(AgCl) = m(AgCl)/M(AgCl)
= m(AgCl)/143,321; n(MCl2)
= 1/2n(AgCl)
M(MCl2) = m(MCl2)/ n(MCl2);
A(M) = M(MCl2) - 70,906
| |
Число грамов безводного хлористого радия
|
Число грамов хлористого серебра
|
A(M)
|
|
I
|
0.1150
|
0.1130
|
220,8
|
|
II
|
0.1148
|
0.1119
|
223,2
|
|
III
|
0.11135
|
0.1086
|
223,0
|
|
IV
|
0.10925
|
0.10645
|
223,3
|
Среднеарифметическое значение атомной массы составляет
222,6 (±2,2), но погрешность
будет меньше, если усреднить максимальный разброс: 222,1(±1,3).
Погрешность будет совсем небольшой, если усреднять только
три последних результата 223,2(±0,2).
Для дополнительно очищенного препарата:
| |
Число грамов безводного хлористого радия
|
Число грамов хлористого серебра
|
A(M)
|
|
I
|
0.09192
|
0.08890
|
225,5
|
|
II
|
0.08936
|
0.08627
|
226,0
|
|
III
|
0.08839
|
0.08589
|
224,1
|
Среднее значение составляет 225,2(±1,1),
что вполне согласуется с современными значениями 226,0254.
М. Кюри записала: "Из этих опытов для атомного веса
радия выходит число 225. Я приписываю этому числу точность
до одной единицы."
2. Содержание радия в первом препарате можно рассчитать
из значения атомной массы 223,2(±0,2):
223,0 - 223,4.
х - мольная доля радия; тогда (1-х) - мольная доля бария.
226,03х + 137,33(1 - х) = 223,0 х = 0,966 (96,6%
моль.)
226,03х + 137,33(1 - х) = 223,4 х = 0,970 (97% моль)
или 96,8(±0,2)% моль.
Содержание по массе металла:
(226,03  0,966)/(226,03
0,966)/(226,03  0,966
+ 137,33
0,966
+ 137,33  0.034) = 0,979
(97,9%)
0.034) = 0,979
(97,9%)
(226,03  0,970)/(226,03
0,970)/(226,03  0,970
+ 137,33
0,970
+ 137,33  0.030) = 0,982
(98,2%)
0.030) = 0,982
(98,2%)
или 98,0(±0,2)% по массе металла.
Для очищенного препарата:226,03х + 137,33(1 - х) = 225,2
х = 0,991 или 99,1(±0,9)%
моль.
По массе : 99,5(±0,5)%.
3. М. Кюри явно ожидала для радия атомной массы близкой
к 226. В периодической таблице Д. И. Менделеева тех лет
в 6 периоде стояли только два элемента: Th (232) в 4-ой
группе и U (238) в 6-ой группе, все остальные элементы были
еще не открыты. По разности масс оценочное значение для
радия должно быть близко к 226.
4.
 ®
®
 + 3
+ 3 + 2b + g
+ 2b + g
5. В. Маяковский ("Разговор с фининспектором о поэзии").
При вековом равновесии соотношение определяется скоростью
распада: N1l1=N2l2
. Количество радия в препарате можно определить из задания
1 (можно брать минимальное содержание - 3,9 10-3
моль.) Тогда количество равновесного
10-3
моль.) Тогда количество равновесного 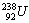 составит
10,5
составит
10,5 109 моль или
44,1 т урана, учитывая содержание урана в U3O8,
потребуется как минимум 52 т. (М. Кюри использовала
не саму руду, а отходы после выделения урана. Основные процедуры
разделения выполнялись на заводе по переработке урановой
руды Дебьерном, в результате которых оставалось 10 - 20
кг сульфатов с активностью в 30 - 60 раз превышающих активность
металлического урана. Эти остатки уже непосредственно перерабатывала
М. Кюри в Париже.)
109 моль или
44,1 т урана, учитывая содержание урана в U3O8,
потребуется как минимум 52 т. (М. Кюри использовала
не саму руду, а отходы после выделения урана. Основные процедуры
разделения выполнялись на заводе по переработке урановой
руды Дебьерном, в результате которых оставалось 10 - 20
кг сульфатов с активностью в 30 - 60 раз превышающих активность
металлического урана. Эти остатки уже непосредственно перерабатывала
М. Кюри в Париже.)
6. 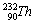 ®
®
 + a
+ g
+ a
+ g
Значение близкое к 228 (содержание 224Ra ничтожно
из-за малого периода полураспада). Выделить значительные
(соизмеримые с граммовыми) количества 228Ra практически
невозможно из-за малого содержания в равновесии с торием.
7. Химические свойства радия весьма близки к свойствам
бария:
RaCl2 + H2SO4 = RaSO4 + 2HCl
+ 2HCl
RaCl2 + Na2CO3 = RaCO3 + 2NaCl
+ 2NaCl
Задача 2. (автор В.А.Колесов)
1. Газообразным соединение с кремнием может быть
фторид - SiF4. Второй газообразный продукт имеет
большую молярную массу - ксенон. Тогда соединения I-III
- фториды ксенона: XeF2, XeF4, XeF6
( составы рассчитываются из плотностей продуктов реакции
с кремнием).
2. Исходные смеси (ксенона и фтора) имеют состав:
x - мольная доля фтора; (1-х) - мольная доля ксенона, тогда
38х + 131,3(1-х) = D 29
29
Для I: 38х + 131,3(1-х) = 2,919  29 = 84,65
29 = 84,65
93,3х = 46,65; х = 0,5, т.е. ксенон и фтор взяты в стехиометрическом
соотношении 1 : 1. (Xe - 50%; F2 - 50%)
Для II: : 38х + 131,3(1-х) = 1,847  29 = 53,56; х = 0,1666, т.е. соотношение фтора и ксенона
составляло 5 : 1 (фтор в заметном избытке). (Xe = 16,67%;
F2 - 83,33%).
29 = 53,56; х = 0,1666, т.е. соотношение фтора и ксенона
составляло 5 : 1 (фтор в заметном избытке). (Xe = 16,67%;
F2 - 83,33%).
Для III: : 38х + 131,3(1-х) = 1,464  29 = 42,456; х = 0,95, т.е. соотношение фтора и ксенона
составляло 19 : 1. (Xe = 5%; F2 - 95%).
29 = 42,456; х = 0,95, т.е. соотношение фтора и ксенона
составляло 19 : 1. (Xe = 5%; F2 - 95%).
3. Состав продуктов взаимодействия I - III с кремнием.
I : х - доля фторида кремния; (1-х) - доля ксенона; 104х
+ 131,3(1 - х) = 4,215  29=
122,2; х = 0,333. SiF4 - 33,3%; Xe - 66,7%.
29=
122,2; х = 0,333. SiF4 - 33,3%; Xe - 66,7%.
II : 104х + 131,3(1 - х) = 4,058  29= 117,68; х = 0,5; SiF4-50%; Xe - 50%.
29= 117,68; х = 0,5; SiF4-50%; Xe - 50%.
III : 104х + 131,3(1 - х) = 3,964  29= 114,96; x = 0,6; SiF4 - 60%; Xe - 40%.
29= 114,96; x = 0,6; SiF4 - 60%; Xe - 40%.
4.Xe + F2 = XeF2
Xe + 2F2 = XeF4
Xe + 3F2 = XeF6
2XeF2 + Si = 2Xe + SiF4
XeF4 + Si = Xe + SiF4
2XeF6 + 3Si = 2Xe + 3SiF4
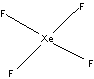
5. XeF2 - линейная молекула ( sp3d
-гибридизация или одна трехцентровая четырехэлектронная
связь): F- Xe- F
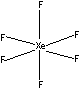
XeF4 - квадратная молекула (sp3d2-гибридизация
или две трехцентровые четырехэлектронные связи):
XeF6 : октаэдр (три трехцентровых четырехэлектронных
связи):
6. Оксофторид ксенона XeOF4: 2XeF6
+ SiO2 = 2XeOF4 + SiF4
7. Приведенное в условии значение энергии связи
относится к связи в молекуле фтора и соответствует энтальпии
(теплоте) реакции:
F2 (газ)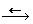 2F(газ)
2F(газ)
Энергию связи Xe - F можно определить как половину энтальпии
(теплоты) для реакции: XeF2 (газ)®Xe(газ)
+ 2F(газ)
Так как стандартная энтальпия образования дифторида ксенона
соответствует реакции:
Xe(газ) + F2 (газ)®XeF2(тв.)
тогда DH связи Xe -
F для XeF2 будет равна 1/2(DHf
+ DHсубл. - DHсв.(F2))
= 1/2(-176 + 51 -155) = -140 (кДж/моль).
Для XeF4DHсв.(Xe
- F) = 1/4(DHf
+ DHсубл. - 2DHсв.(F2))
= -124 (кДж/моль)
Для XeF6DHсв.(Xe
- F) = 1/6(DHf
+ DHсубл. - 3DHсв.(F2))
= -138 (кДж/моль)
Среднее значение энергии связи составляет 134 кДж/моль.
8. Выход определяется по веществу, взятому в недостатке,
в данном случае по ксенону.
В этом году исполняется 100 лет с присуждения Нобелевской
премии по химии У. Рамзаю "В признание открытий
в атмосфере различных инертных газов и определения их места
в периодической системе элементов".
Задача 3 (автор Ю. Н. Медведев).
1). Осмий.
2).А – OsO4 – тетраоксид осмия или «Osmium
Saure» (нем. – осмиевая кислота).
Б – K[NOsO3] – осмиамат калия (соль осмиамовой
кислоты).
В – K2[OsO4(OH)2]
– осмат (VIII) калия, дигидроксотетраоксоосмат (VIII) калия.
Г – K2OsO4∙2H2O
– осмат (VI) калия.
Д – OsO2 – диоксид осмия
Пояснение к ответу:
A). Соединение А судя по способу получения
– оксид.
MOn + 2mI– + 2mH+ →
MOn–m + mI2 + mH2O
I2 + 2S2O32–
→ S4O62– + 2I–
n(I2) = 0,5n(S2O32–)
= 0,5∙0,025∙0,05 = 6,25∙10–4
моль
n(MOn) = 1/m∙n(I2) = 6,25∙10–4/m
моль
M(MOn) = 0,07944∙m/6,25∙10–4
= 127,1m г/моль
Атомную массу найдем перебором (допустим расчет через эквивалент):
| |
M(MOn)
|
Атомная масса металла
|
|
n=1
|
n=2
|
n=3
|
n=4
|
|
m=1
|
127,1
|
111?
|
95,1?
|
79,1?
|
63,1?
|
|
m=2
|
254,2
|
238,2?
|
222,2?
|
206,2?
|
190,2 – Os
|
Следовательно, А – OsO4.
Б). K:N = 13,39/39 : 4,81/14 = 1:1, значит KN… .
Очевидно, ц. атом – это осмий. Указание на тетраэдрическое
окружение ц. атома позволяет приписать еще 3 атома О: K[NOsO3].
В). Ясно, что это продукт присоединения КОН к OsO4:
OsO4∙nKOH. Указание на коорд. число = 6
позволяет считать, что n = 2: OsO4∙2KOH
или K2[OsO4(OH)2].
Д). Для осмия, кроме OsO4, устойчив лишь
оксид осмия (IV) – OsO2
Г). Данное соединение содержит осмий в степени
окисления, промежуточной между IV и VIII: (n+m) [Os] →
nOsO4 + mOsO2
По условию n = m = 3,125∙10–4 моль
(подсчитайте самостоятельно).
Следовательно, степень окисления осмия +VI. Этим соединением
может быть осмат (VI) калия K2OsO4.
Найдем для проверки молярную массу:
М = m/n = 0,2301/2∙3,125∙10–4 = 368,2
г/моль, в то время как М(K2OsO4) =
332,2 г/моль. Недостающие 368,2 – 332,2 = 36 г/моль отвечают
2Н2О, тогда вещество Г – K2OsO4∙2Н2О.
3).K[NOsO3], K2[OsO4(OH)2],
K2[OsO2(OH)4] (напомним,
что в последнем соединении нет молекул воды, в то время
как К.Ч. осмия по условию равно 6).
4). +VIII. Например Fe, Ru, Xe.
5). Os + 2NO2 → OsO4
+ N2 (или NO)
OsO4 + 4I– + 4H+ →
OsO2 + 2I2 + 2H2O
I2 + 2S2O32–
→ S4O62– + 2I–
2 K2OsO4 + 4H+
→ 4K+ + OsO4 + OsO2 +
2H2O
OsO4 + KOH + NH3 → K[NOsO3]
+ 2H2O
OsO4 + 2KOH → K2[OsO4(OH)2]
[OsO4(OH)2]2– + 2H2O
+ 2ē → [OsO2(OH)4]2–
+ 2OH–
Задача 4 (автор С.А.Серяков)
1. Вещество А содержит серу, на это указывает
ряд фактов:
а) название препарата созвучно слову sulfur,
б) А получается действием сероводорода на соль А6
в кислой среде,
в) газообразный продукт окисления - B1 содержит
серу (термическое разложение B3),
г) соединения серы широко используются в медицине.
Тогда X - S, B1 – SO2,
B3 – K2SO3, B4
– SO3, B5 – K2SO4,
B6 – H2S2O3,
B – S (S8).
Определим состав вещества А, предположив состав ЭSn/2(n
– натуральное):
M(Э) = (55%/45%)*16n
|
M(Э)
|
19.6
|
39.11
|
58.7
|
78.2
|
97.8
|
117.3
|
136.8
|
156.4
|
|
n
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
Э не может быть F, K, Fe-Ni, Mo, Tc, In, Sn, Ba, Gd – поскольку
все эти элементы не образуют сильных двухосновных кислородных
кислот (A4). Таким образомЭ = Se (M=78.96)
А - SeS2, Y – Se, A1
– SeO2, A2 – Se(Se∞),
A3 – K2SeO3, A4
– H2SeO4, A5 – K2SeO4,
A6 – H2SeO3, A7
– SeO3.
Действие серы на K2SeO3 приводит к
K2SeO3S8-n –
«хвост» из атомов серы присоединяется к атому селена, аналогичные
вещества - K2SO3Se8-n
получаются действием селена на K2SO3.
Среди этих соединений изомерами являются C1
– K2SeO3S, C2 –
K2SO3Se.
Уравнения реакций:
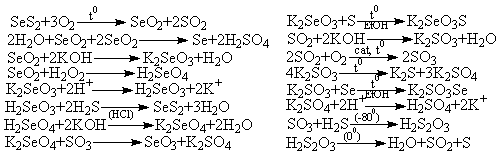
2. Реакция получения С1 и С2
– гетерогенная. Спирт улучшает смачивание водными растворами
солей – неполярные селен и серу, снижая поверхностное натяжение
между реагирующими фазами. Это увеличивает площадь массообмена,
т. е. скорость реакции.
3. На циклическую структуру указывает наличие общих
фрагментов - -SS- для А и В.
М. Д. Машковский приводит следующую структуру для SeS2,:

Согласно современной информации подобные соединения содержат
в своем составе восьмичленные циклы, включающие атомы селена
и серы: S8-kSek. Элементарному
составу SeS2 отвечает, например, комбинация циклов
Se4S4 и Se2S6
в равных количествах.
Дисульфидные и селеносульфидные мостики восстанавливаются,
до тиоловых групп, которые, связывают катионы d-элементов,
активирующих работу ферментов в сульфидные производные и
тем самым нарушают деятельность микроорганизмов.
4. В качестве катализаторов окисления SO2
используются V2O5, Pt в контактном
способе и NO в нитрозном способе.
5. Расстановка коэффициентов:

Задача 5 (автор С.А.Серяков).
В соответствии с предположениями экспериментаторов, один
из оксидов должен быть наиболее устойчив к термическим воздействиям.
Тогда возможные реакции с участием оксида Б:
ЭОn/2 +m/4O2 = ЭО(n+m)/2(i)
ЭOn/2 = kЭО(n+m)/2 + (1-k)Э(газ)
Пусть n, m – целые, значит:  для
молярной массы Э можно получить следующее соотношение:
для
молярной массы Э можно получить следующее соотношение: :
:
|
n+m
|
2
|
3
|
4
|
5
|
6
|
7
|
|
M(Э)
|
39(K)
|
58,5(Fe-Ni)
|
78(Se)
|
Tc(97,5)
|
117(Sn)
|
136,5(Ba)
|
|
Оксид I
|
K2O2
|
Fe2O3
|
SeO2
|
<Tc2O5>
|
нет
|
нет
|
Поскольку железо и технеций – нелетучи, а для селена оксиды
со степенью окисления меньше +4 не описаны, SeO2
– не окрашен и состав Г и Д в этом случае
нелеп, единственный подходящий вариант – K.
Оксиды калия(A-K), использованные в опытах: Б
– K2O, В – K2O2,
Г – KO2, Д – KO3.
Схемы реакций:
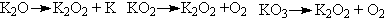
Рассчитывая аналогичным образом состав вещества Е,
получаем соотношение калия и кислорода 2:3, описанные химические
свойства указывают на индивидуальность соединения (образование
тригидрата, существование в водном растворе). Все это наводит
на мысль, что произошла реакция между материалом стаканчика
и оксидами (во многих книгах упоминается, что работа со
щелочами и их оксидами в платиновой посуде при высоких температурах
сопровождается химическими изменениями последней). Тогда
Е – K2PtO3, Ж – PtO2(PtO2*2H2O),
З – Pt.
Экспериментаторы не предполагали протекание побочных процессов,
отсюда – разногласие теории и эксперимента.
Уравнения реакций:
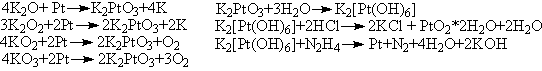
Тригидрат устойчив, поскольку для платины(+4) характерно
координационное число VI. В образовавшемся комплексном ионе
в качестве лигандов высупают OH- группы, сформированные
из молекул воды. Обычно из раствора получают K2[Pt(OH)6]*0.5H2O.
Диоксид платины, как и сама мелкодисперсная платина используются
в качестве катализаторов многих реакций: окисление NH3,
окисление промышленных газов (СО и др.), гидрирование растительных
масел и проч.
При работе с оксидами щелочных металлов при высоких температурах
используют серебряные тигли (до 960о).
Способы получения оксидов калия:
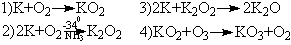
Комментарии:
Сгорание калия в кислороде приводит к образованию KO2
(с небольшой примесью K2O2). Пропускание
кислорода в раствор калия в жидком аммиаке дает пероксид,
восстановление последнего металлическим калием приводит
к оксиду, избыток восстановителя отгоняют в вакууме. Действие
озона на KO2 позволяет получить озонид, который
экстрагируют из смеси с помощью жидкого аммиака.
Задача 6 (автор В.А.Емельянов).
1. Из данных C, H, N анализа легко находится соотношение
атомов этих элементов в соединениях А (20,15/12 :
1,34/1 : 28,21/14 = 5 : 4 : 6) и Б (21,48/12 : <0,01/1
: 30,08/14 = 5 : <0,03 : 6). Одинаковое отношение атомов
углерода и азота дает возможность предположить, что эти
вещества содержат одинаковую комплексную частицу, но являются
солями различных катионов (А, по условию, натриевая
соль, Б, скорее всего, медная). Поскольку в медной
соли содержание водорода находится на уровне порога обнаружения,
наиболее вероятно, что в натриевой соли он входит в состав
кристаллизационной воды. Из данных о выходе продукта можем
рассчитать содержание в нем железа и молекулярную массу
вещества, приходящуюся на 1 атом железа. При 100 % выходе
получилось бы 67,7/0,8 г продукта, причем эта масса содержит
120/422,2 моль железа. Отсюда М = (67,7*422,2)/(0,8*120)
= 297,7 г/моль. В результате уже проведенных расчетов и
рассуждений пока имеем состав NaFe(CN)5N*2H2O,
не дотягивающий до 297,7 на 38,9 а.е.м., что практически
в точности соответствует еще одному катиону натрия и атому
кислорода.
Наши выводы легко проверяются по данным анализа Б.
Его молекулярная масса, при условии что в состав молекулы
входят 5 атомов углерода и 6 атомов азота, составляет 12*5/0,2148
= 279,3 а.е.м. Эти два элемента и железо дают 199,8 а.е.м.;
оставшиеся 79,5 а.е.м. это как раз катион меди и атом кислорода.
Таким образом, соединение А – «нитропруссид» натрия,
комплексный анион которого получен в результате обычной
реакции нитрозирования (взаимодействие с нитритом в кислой
среде), на самом деле является нитрозокомплексом. Его формулу
следует записывать как Na2[Fe(NO)(CN)5]*2H2O.
По современным представлениям NO-группа в этом комплексе
несет положительный заряд и тогда его правильное название
по систематической номенклатуре дигидрат пентацианонитрозилийферрата(II)
натрия. Соединение Б - Сu[Fe(NO)(CN)5]
– пентацианонитрозилийферрат(II) меди(II).
2. Сульфатами железа(II) и меди(II) раствор испытывают
на отсутствие гексацианоферрат(III)- и гексацианоферрат(II)-ионов
соответственно:
Fe2+ + [Fe(CN)6]3- + K+
= KFe[Fe(CN)6] (Fe3[Fe(CN)6]2
(Fe3[Fe(CN)6]2 – синее окрашивание;
– синее окрашивание;
2Сu2+ + [Fe(CN)6]4- = Сu2[Fe(CN)6] - бурый осадок (при отсутствии – светло-зеленый).
- бурый осадок (при отсутствии – светло-зеленый).
Если эти ионы присутствуют в растворе в заметном количестве,
они будут загрязнять нужный продукт.
3. Во-первых, при высокой концентрации азотистой кислоты
в растворе значительная ее доля будет просто диспропорционировать
на оксид азота(II) и азотную кислоту (и диоксид азота),
во-вторых, высокая концентрация окислителя (HNO2)
приведет к окислению более чем одного координированного
цианид-иона в молекуле комплекса. Если изменить порядок
добавления реагентов, то нагревание исходного гексацианоферрата
в кислой среде также приведет к разрушению комплекса, но
в этом случае за счет протонирования координированного цианид-иона,
замещения его на воду и удаления синильной кислоты из раствора.
Поскольку в результате одноэлектронного окисления
азотистой кислотой в растворе желтая кровяная соль достаточно
быстро превращается в красную, можно использовать и красную
кровяную соль.
4. Уравнения реакций:
2K4[Fe(CN)6]+4NaNO2+ 4H2SO4
= 2K2[Fe(NO)(CN)5]+NO+(CN)2+2Na2SO4+2K2SO4+
+4H2O;
2Сu[Fe(NO)(CN)5]+4NaHCO3 = 2Na2[Fe(NO)(CN)5]+(CuOH)2CO3 +3CO2+H2O.
+3CO2+H2O.
5. При осаждении нитропруссид меди за счет сорбции захватывает
заметное количество сульфат-ионов, которые при обработке
гидрокарбонатом переходят в раствор.
Уксусную кислоту и ацетат бария добавляют для перевода оставшегося
в растворе гидрокарбоната натрия и образовавшегося сульфата
натрия в лучше растворимый и хуже сорбирующийся ацетат.
6. При разложении комплексного цианида одним из продуктов
должен быть очень устойчивый цианид натрия, другим – соединение
железа. Масса остатка от 1 моля комплекса составляет 0,53*297,8
= 157,8 г. За вычетом 2 молей NaCN и массы 1 моля железа
остается всего 4 г. Это соответствует 4 молям Н, четверти
моля О или трети моля С. Подходит только третий вариант
– и, соответственно карбид железа Fe3C. Собственно,
в этом нет ничего удивительного, поскольку цианиды являются
сильными восстановителями, а карбид железа термически очень
устойчив. Реакция термолиза выглядит следующим образом:
6Na2[Fe(NO)(CN)5]*2H2O
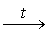 12NaCN
+ 2Fe3C + 6NO + 8(CN)2
+ N2 + 12H2O.
12NaCN
+ 2Fe3C + 6NO + 8(CN)2
+ N2 + 12H2O.
7. Под действием света происходит разрыв связи Fe-NO с
выделением оксида азота:
[Fe(NO)(CN)5]2- + H2O
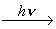 [Fe(H2O)(CN)5]2-
+ NO.
[Fe(H2O)(CN)5]2-
+ NO.
Образующийся в этой реакции комплекс должен быть окрашен
в тот же красный цвет, однако ряд побочных реакций, протекающих
особенно активно в присутствии кислорода, вызывает дальнейшее
разрушение комплекса, вплоть до катионных форм:
2NO+O2=2NO2, 2NO2 + H2O
= HNO2 + HNO3,
[Fe(H2O)(CN)5]2- + HNO2
+ H+ = [Fe(H2O)2(CN)4]-
+ 1/2 (СN)2 + NO ит.д.
Наличие в системе как окислителей, так и восстановителей,
приводит к тому, что железо присутствует в растворе также
в двух степенях окисления, электронные переходы между которыми
и вызывают появление глубокой интенсивной окраски.
ОРГАНИЧЕСКАЯ ХИМИЯ
Задача 1 (автор И.А.Трушков)
1) Синтез Книжникова описывается следующей схемой:
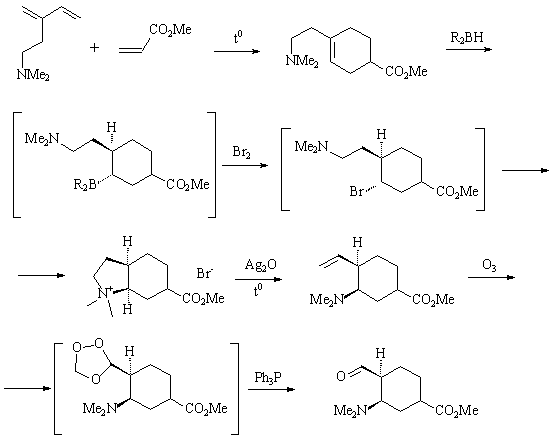
Интермедиаты, заключенные в скобки, не выделяются в чистом
виде:
а) озонид нестабилен и должен быть немедленно подвергнут
восстановительному разложению (кроме трифенилфосфина на
этой стадии можно использовать диалкилсульфид или цинк в
кислоте);
б) при попытке выделения бромида он подвергается циклизации
с образованием циклической соли аммония, хотя, если реакцию
бромирования борана проводить при охлаждении, образование
бромида в реакционной среде можно зафиксировать;
в) бораны, содержащие атомы азота или кислорода, обычно
образуют внутри- и межмолекулярные комплексы переменного
состава, поэтому их не выделяют.
2) Избыток борана (как B2H6, так
и алкилборанов) приведет к восстановлению сложного эфира
до спирта. RCOOR’ + B2H6®RCH2OH
Избыток брома может вызвать окисление по атому углерода,
связанному с аминогруппой и/или бромирование енольной формы
сложноэфирного фрагмента.
RCH2NMe2 + Br2®
RCONMe2 + RCH2N(Me)CHO (послегашенияводой)
RR’CHCO2Me ↔ RR’C=C(OH)OMe + Br2®
RR’CBr-COOMe
3) Молекула содержит три стереоцентра. Следовательно, для
нее возможно 8 стереоизомеров (4 диастереомера, каждый –
в виде двух энантиомеров).
4) По схеме Книжникова образуется два диастереомера продукта
1:

Диастереомеры имеют разные физические свойства и могут
быть разделены, например, с помощью хроматографии.
Каждый диастереомер будет получаться в виде рацемической
смеси двух энантиомеров. Для разделения энантиомеров можно
использовать обработку рацемата 1) (-)-винной кислотой,
в результате чего образуются диастереомерные соли, которые
могут быть разделены; или 2) обработку (S)-фенилэтиламином
с образованием диастереоизомерных иминов. Разделение последних
и гидролиз приводит к получению чистых энантиомеров.
5) Например, реакция дивинилкетона с диметиламином с последующей
реакцией Виттига с метилтрифенилфосфоний бромидом в присутствии
основания.
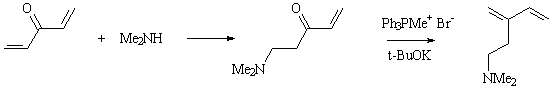
Задача 2 (автор И.А.Трушков)
Выпадение осадка при пропускании газовой смеси через известковую
воду может быть вызвано двумя реакциями:
Ca(OH)2 + CO2 = CaCO3 + H2O (1)
+ H2O (1)
Ca(OH)2 + SO2 = CaSO3 + H2O (2)
+ H2O (2)
Изменение массы осадка при пропускании газов через раствор
NaOH с последующим добавлением CaCl2 ясно показывает,
что в данном случае протекают обе эти реакции, поскольку
при стоянии на воздухе медленно происходит окисление сульфита
натрия в сульфат кислородом воздуха:
2Na2SO3 + O2 = Na2SO4
(3)
Na2SO3 + CaCl2 = CaSO3
 (4)
(4)
Na2SO4 + CaCl2 = CaSO4
 (5)
(5)
Следовательно, предполагая образование х моль СО2
и y моль SO2 при сжигании вещества А, можно составить
следующее уравнение: 100x + 120y = 1.716
Выпадение осадка в реакции серебра может быть обусловлено
двумя причинами: реакцией с альдегидами, ведущей к образованию
металлического серебра:
RCHO + 2 [Ag(NH3)2]OH = RCOONH4
+ 3 NH3 + H2O + 2 Ag (6)
(6)
и реакцией с тиолами, образующимися при действии на
соединение А подкисленным раствором соли ртути(II):
RSH + [Ag(NH3)2]OH = RSAg +
2NH3 + H2O (7)
+
2NH3 + H2O (7)
Наличие тиолов в реакционной смеси подтверждается реакцией
с иодом, в которую альдегиды не вступают, в то время как
тиолы в этих условиях дают дисульфиды:
2RSH + I2 = RS-SR + 2 HI (8)
В этой реакции расходуется 0.762 г иода, что соответствует
0.003 моль I2. Следовательно, в реакцию вступило
0.006 моль тиолов.
Таким образом, можно составить еще одно уравнение:
0.006(108+32+z) + 108n = 2.226, где z – масса радикала R,
а n – число молей серебра, соответствующее 2n молей альдегида.
Из условия задачи ясно, что тиол(ы) и альдегид(ы) образуются
при обработке вещества А подкисленным раствором соли ртути
(II). Этот реагент используется для получения альдегида
из ацетилена (реакция Кучерова), однако в случае замещенных
ацетиленов в этой реакции образуются не альдегиды, а кетоны
(и не образуются тиолы). Другая реакция, катализируемая
солями ртути – гидролиз дитиокеталей RS-CR’R’’-SR’’’:
RS-CR’R’’-SR’’’ + H3O+ (Hg2+)
= RSH + R’’’SH + R’R’’C=O(9)
В случае образования кетона осадок с солью серебра дают
только тиолы, в случае образования альдегида продуктом реакции
также является серебро.
Поскольку при гидролизе из одного моля тиокеталя образуется
два моля тиолов, а в реакцию с иодом вступает 0.006 моль
тиолов, 0.324 г соединения А соответствуют 0.003 моля. Молекулярный
вес соединения А равен 108. Следовательно, суммарная масса
заместителей R, R’, R'', R''' равна 108 – (32х2 + 12) =
32. Это соответствует двум атомам углерода и восьми атомам
водорода. Следовательно, соединение А может иметь
формулу CH3SCH2SCH3;
С2H5SCH2SH; CH3SCH(CH3)SH;
HSCHC2H5SH или(CH3)2C(SH)2.
Правильной является первая формула, поскольку:
1)четыре остальных соединения являются неустойчивыми (аналогично
неустойчивости 1,1-диолов и полуацеталей) и
2) только в этом случае масса осадка при обработке оксидом
серебра равна 2.226 г:
СH3SH + [Ag(NH3)2]OH =
CH3SAg + 2NH3
+ H2O (7’) 0.006 моль CH3SAg
– 0.93 г.
+ 2NH3
+ H2O (7’) 0.006 моль CH3SAg
– 0.93 г.
HCHO+ 4 [Ag(NH3)2]OH = (NH4)2CO3
+ 4 Ag + 6 NH3
+ 2 H2O (6’) 0.012 моль Ag – 1.296 г.
+ 6 NH3
+ 2 H2O (6’) 0.012 моль Ag – 1.296 г.
Ответы:
1) А - CH3SCH2SCH3
2). Ca(OH)2 + CO2
= CaCO3 + H2O
(1)
+ H2O
(1)
Ca(OH)2 + SO2 = CaSO3 + H2O (2)
+ H2O (2)
2 Na2SO3 + O2 = Na2SO4
(3)
Na2SO3 + CaCl2 = CaSO3
 (4)
(4)
Na2SO4 + CaCl2 = CaSO4
 (5)
(5)
RCHO + 2 [Ag(NH3)2]OH = RCOONH4
+ 3 NH3 + H2O + 2 Ag (6)
(6)
HCHO + 4 [Ag(NH3)2]OH = (NH4)2CO3
+ 4 Ag + 6 NH3
+ 2 H2O (6’)
+ 6 NH3
+ 2 H2O (6’)
RSH + [Ag(NH3)2]OH = RSAg + 2NH3 + H2O (7)
+ 2NH3 + H2O (7)
СH3SH + [Ag(NH3)2]OH
= CH3SAg +
2NH3 + H2O (7’)
+
2NH3 + H2O (7’)
2 RSH + I2 = RS-SR + 2 HI (8)
RS-CR’R’’-SR’’’ + H3O+ (Hg2+)
= RSH + R’’’SH + R’R’’C=O (9)
3) Циклогексанон может взаимодействовать как с метантиолом,
так и с формальдегидом. Однако первая реакция обратима и
в данных условиях (использованных для осуществления обратной
реакции расщепления дитиокеталя) невозможна. Каталитические
количества кислоты инициируют реакцию альдольной конденсации
циклогексанона (метиленовая компонента) с формальдегидом
(карбонильная компонента). Первоначально образуется 2-гидроксиметилциклогексанон,
при недостатке циклогексанона дальнейшее взаимодействие
приводит к продуктам бис-, трис- и тетракис(гидроксиметилирования)
– вплоть до образования 2,2,6,6-тетра(гидроксиметил)циклогексанона.
При избытке циклогексанона протекает реакция его самоконденсации,
ведущая к продукту кротоновой конденсации {2-(циклогексилиден)циклогексанону}.

4) Изменение массы осадка при пропускании газов
через раствор NaOH с последующим добавлением CaCl2
обусловлено протеканием реакций (3)-(5). Сразу
после пропускания газовой смеси CaCl2 реагирует
только с сульфитом натрия. Через некоторое время часть Na2SO3
окисляется до Na2SO4, что ведет к
увеличению массы осадка (CaSO3 + CaSO4)
вместо только CaSO3.
Задача 3 (автор А.А.Зайцев)
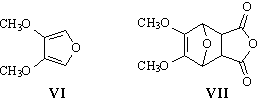
1. Взаимодействие вещества VI с малеиновым ангидридом
(превращение VI® VII)
– реакция Дильса-Альдера (состава соединения VII
– сумма составов VI и малеинового ангидрида), причём
вещество VI является диенофилом:

Так как в конечном продукте содержатся две метокси-группы,
логично предположить, что и в веществах VI и VII
также имеются две OMe-группы (3 = 4 = OMe). Тогда на заместители
1, 2, 5 и 6 в соединении VI приходится 2 атома водорода
и 1 атом кислорода (C6H8O3
– C4 – C2H6O2
= H2O). Исходя из этого, для VI и VII
логично предположить следующие структуры:
Состав VI отличается от состава III на C2O4
(возможно, 2 молекулы CO2), т.е. формальный результат
двух стадий превращения III в VI – это декарбоксилирование.
Последнее, по всей видимости, происходит при действии меди
в хинолине (стандартный мягкий способ декарбоксилирования
кислот). Тогда вещество V имеет следующую структуру:

Отсюда понятно, что превращение IV®V
– это гидролиз эфира кислоты V, тогда III®IV
– метилирование (но, естественно, не карбоксильных) OH-групп:
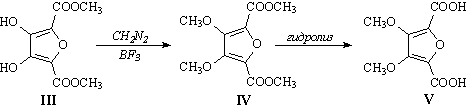
Соединение III получается в результате конденсации
диметилоксалата (I) и диметилового эфира 2,2’-оксидиуксусной
кислоты (II).
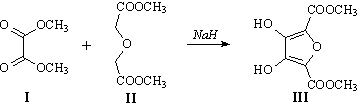
Задача 4 (автор Е.Д.Каньшин)
Ниже приведена схема, в которой указаны структуры всех
промежуточных веществ.
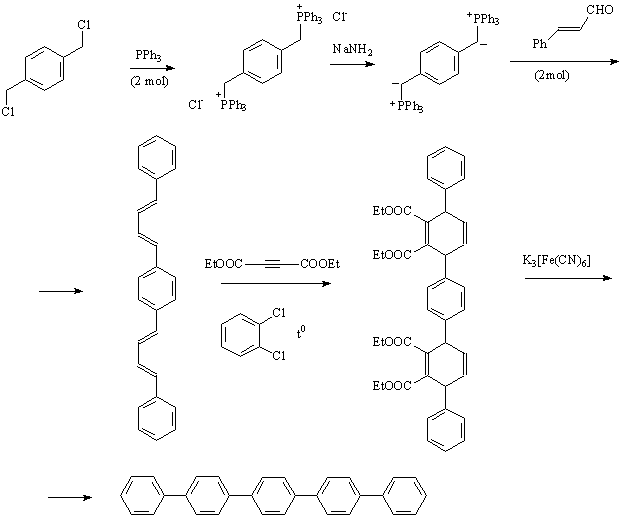
Синтез основан на реакциях Виттига и Дильса-Альдера. На
первой стадии атомы хлора, находящиеся в бензильных положениях,
замещаются на трифенилфосфиновые группировки, данный процесс
представляет собой нуклеофильное замещение. В полученном
продукте атомы водорода метиленовых групп обладают повышенной
кислотностью в силу присутствия как ароматического ядра,
так и положительно заряженных атомов фосфора, находящихся
по соседству. Именно эти протоны удаляются под действием
основания – амида натрия, что приводит к образованию илида
фосфора, взаимодействие которого с кротоновым альдегидом
есть ни что иное как реакция Виттига, широко используемая
в органическом синтезе для получения новых С=С связей. Следующая
стадия является присоединением по Дильсу-Альдеру. Далее
полученный аддукт подвергают декарбоксилированию, сопровождающемуся
ароматизацией, что дает конечный углеводород.
Задача 5 (автор Решетова М.Д.)

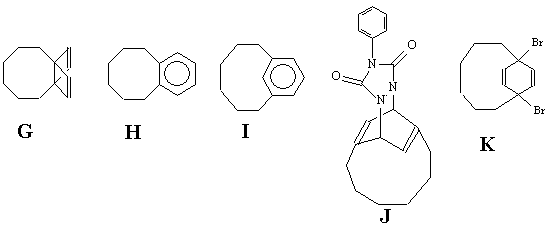
“Benzene is flat. Every undergraduate chemistry student
learns early in his career that the extraordinary stability
of benzene is associated with the cyclic overlap of six
π orbitals. Naturally chemists have addressed
themselves to the question of how much bending a benzene
ring can withstand without giving up its “aromatic character”
(J.Amer.Chem.Soc., v.96, №8, p.2643, 1974) – этимисловаминачинаетсястатья,
описывающаяпервыйсинтез [6]парациклофана.
“Ароматичность” соединения обусловлена наличием
двух групп макроскопических свойств: 1) химических – ароматические
соединения в малой степени проявляют склонность к присоединению,
характерную для ненасыщенных систем, но обнаруживают склонность
к электрофильному замещению; 2) специфические спектральные
свойства, среди которых особенно важны и характерны особенности
спектров ЯМР. В молекуле ароматического соединения, помещенной
во внешнее магнитное поле, под влиянием последнего индуцируется
кольцевой ток. Магнитный момент, обусловленный этим
током, над плоскостью ароматического кольца совпадает с
направлением внешнего магнитного поля, а за пределами кольца
– против внешнего магнитного поля. Это вызывает существенные
и характерные изменения величин химических сдвигов протонов
в спектрах ЯМР: характерный диапазон химических сдвигов
протонов, непосредственно связанных с углеродами ароматического
скелета и находящимися вне цикла (например, в бензоле),
составляет 7 – 8 м.д. (по сравнению с протонами в винильных
положениях 4 – 6 м.д. сдвинуты в более слабые поля); если
протоны находятся внутри ароматического цикла (например,
в [18]аннулене), химические сдвиги находятся в очень сильных
полях (1 )-( -1) м.д.).
В углеводороде Е имеются ароматические
протоны (7,17 м.д.), а также протоны, имеющие хим.сдвиги
в очень сильных полях (0.33 и -0,4 м.д.) – протоны метиленовой
цепочки, которые находятся в сфере влияния собственного
магнитного поля, направление которого над плоскостью бензольного
кольца совпадает с магнитным моментом внешнего магнитного
поля.
Таким образом, согласно спектральным данным
уклеводород Е ароматичен, однако его реакционная
способность напоминает свойства 1,3-диенов. Это связано
с отклонением от плоскости кольца атомов С1 и
С4: согласно данным рентгеноструктурного анализа
8-карбокси[6]парациклофана бензольное кольцо в последнем
имеет конформацию ванны, в которой атомы С1 и
С4, связанные с гексаметиленовым мостиком, отклонены
от базовой плоскости ванны на q
= 20.50.


 ®
®
 + 3
+ 3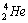 + 2b + g
+ 2b + g составит
10,5
составит
10,5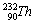 ®
®
 + a
+ g
+ a
+ g

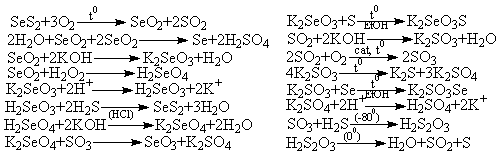


 для
молярной массы Э можно получить следующее соотношение:
для
молярной массы Э можно получить следующее соотношение: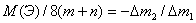 :
: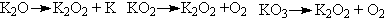
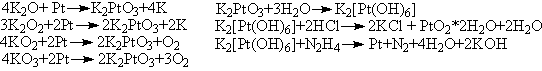
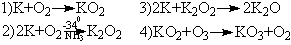
 12NaCN
+ 2Fe3C + 6NO + 8(CN)2
+ N2 + 12H2O.
12NaCN
+ 2Fe3C + 6NO + 8(CN)2
+ N2 + 12H2O. [Fe(H2O)(CN)5]2-
+ NO.
[Fe(H2O)(CN)5]2-
+ NO.