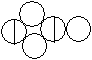|
Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по химии - 2004 г.
ДЕВЯТЫЙ КЛАСС
Задача 9-1.
"За ручкою руку опустишь в карман -
а дальше ответ однозначен…"
(Бахыт Кенжеев)
"Селитреный газ, согласно Кирвану, имеет
удельный вес 1,19; согласно Дэви 1,102; последнее и
теперь является наилучшим приближением,
поскольку это показывают мои опыты. Этот газ
чрезвычайно вреден при вдыхании его в
разбавленном состоянии: в чистом состоянии он
мгновенно убивает. Селитряный газ, как уже было
замечено, разлагается электричеством; половина
азота освобождается, а другая половина
соединяется с выделившимся кислородом и
образует селитреную кислоту. Согласно анализу
Дэви по углю, селитреный газ состоит из 2,2 частей
азота и трех частей кислорода по весу или почти 42%
азота и 58% кислорода; это то же, что я получаю
путем электризации и другими средствами.
Др. Генри недавно открыл, что селитреный газ
разлагается аммиачным газом; если смешать оба
газа над ртутью в эвдиометре Вольта, то
электрической искры оказывается достаточно для
того, чтобы их взорвать. Если присутствует
избыток селитреного газа, то продуктами являются
азотный газ и вода с небольшим количеством
селитреной кислоты; если присутствует избыток
аммиака, то получаются азотный газ, вода и
водород. Если аммиачный газ пропускать через
трубку, наполненную раскаленным докрасна
пиролюзитом, то, как нашел др. Мильнер, образуется
селитреный газ."
"Джон Дальтон" (сборник избранных работ по
атомистике 1802-1810), Л., 1940, стр 129)
- Определите состав "селитреного газа"
(формула).
- С какой точностью определили "удельный
вес" Кирван и Дэви (отн. %)?
- Напишите уравнение реакции "разложения
электричеством селитреного газа".
- Напишите уравнение реакции "селитреного газа
с аммиачным газом в эвдиометре". Как меняется
объем в результате реакции, если использовать
стехиометрическую смесь (после приведения
продуктов к исходным условиям)?
- Оцените точность результатов химического
анализа "селитреного газа" по Дэви (ошибка в
относительных %).
- Напишите уравнение реакции "аммиачного газа
с пиролюзитом".
- Предложите уравнения реакций получения
"селитреного газа" (два примера).
- На рисунке в конце текста приведены формулы,
которыми пользовался Дж. Дальтон для соединений
азота. Определите под каким номером обозначен
"селитреный газ", каким составам
соответствуют другие формулы.
Задача 9-2.
" все ж, став записным пиитом, я
по-иному подхожу
к старинным истинам избитым, поскольку ясно и ежу
…"
(Бахыт Кенжеев)
В 1923 г. А. Кэмпбелл изучал растворение металлов
в азотной кислоте. Согласно его данным, при
растворении 6,714 г некоторого металла в 25%-ной
азотной кислоте выделяется 1500 мл газовой смеси,
содержащей окись азота (j = 39,0%, w
= 53,81%), закись азота (j = 21,0%) и ещё
один компонент.
- Установите название третьего компонента
газовой смеси и рассчитайте его массовую долю.
- Рассчитайте плотность выделившейся смеси газов
при н.у.
- Какой металл растворял в своих опытах Кэмпбелл?
Ответ подтвердите расчетом.
- Приведите суммарное уравнение изученной
Кэмпбеллом реакции (в расчете на
1 моль металла).
- Какие химические реакции возможны при
нагревании выделившейся смеси газов?
Задача 9-3.
"…обнаружить истину, из числа
тех, что спят в земле, и рудничной соли,
и любовной влаге."
(Бахыт Кенжеев)
Минерал термонатрит встречается в виде
выцветов в аридных областях, в отложениях
фумарол. Его плотность составляет 2,255 г/см3,
твердость 1 - 1,5. Минерал легко растворяется в
воде. Если растворить 45 г термонатрита в 100 г
воды при 80 оС, то при охлаждении до 20 оС
можно выделить 65,35 г другого минерала (II). При
аккуратном добавлении к оставшемуся раствору 25
мл 36%-ного раствора соляной кислоты (пл. 1,18 г/см3)
образуется 103,23 г раствора, при испарении
которого досуха получается 15,72 г еще одного
минерала (III). Растворение в воде этих
минералов сопровождается различными тепловыми
эффектами (см. таблицу).
Минерал |
масса минерала, г |
масса воды, г |
Dt, oC |
термонатрит |
5,44 |
100 |
+1,05 |
II |
3,97 |
200 |
-1,08 |
III |
3,24 |
200 |
-0,34 |
- Определите состав минералов (формулы).
- Предложите названия минералов II, III.
- Рассчитайте тепловой эффект растворения
минералов (кДж/моль), можно считать теплоемкость
образующихся растворов равной теплоемкости воды
(4,18 Дж/г град).
- При длительном выдерживании в сушильном шкафу
при 100 оС минерал IIпревращается в
термонатрит. Рассчитайте тепловой эффект для
этой реакции (кДж/моль) и изменение массы (%).
- Для указанных минералов нарисуйте качественные
графические зависимости растворимости от
температуры (s - ось абсцисс, t – ось ординат).
- Какой элемент, на Ваш взгляд, обязан своим
названием минералу II?
Задача 9-4.
"пытаясь в мире добавить что-то, как соль на кончике
ножа…"
(Бахыт Кинжеев "Из старых тетрадей")
При длительном электролизе насыщенного
раствора гидрокарбоната калия (при охлаждении,
I=250 мА, U> 16 В, платиновые электроды) выпадают
голубоватые, похожие на лед, кристаллы (пл. 2,14
г/см3). При нагревании выше 140оС
соединение разлагается, теряя в массе 30,3%.
Плотность газообразных продуктов по воздуху 1,38.
Навеска вещества массой 0,1000 г была растворена в 10
мл 10%-ного раствора KI, подкисленного серной
кислотой. На титрование образовавшегося иода
пошло 10,1 мл 0,1 М раствора тиосульфата натрия.
- Определите состав полученного вещества
(формула).
- Напишите уравнение реакций синтеза,
термического разложения и анализа полученного
препарата.
- Напишите уравнение реакции полученного
вещества с разбавленным раствором серной
кислоты.
- Почему, на Ваш взгляд, для синтеза был
использован гидрокарбонат калия, а не более
доступный гидрокарбонат натрия?
- Каково, по Вашему мнению, строение
(геометрическое) полученного соединения
(рисунок).
- Какое из известных Вам соединений получают
аналогичным способом? Какими сходными
свойствами они обладают (уравнения реакций)?
Задача 9-5.
"Дай-ка поделимся, милый, добычей,
всю аккуратно сочтем."
(Бахыт Кенжеев)
В четыреххлористом углероде (600 мл) растворили
бесцветную жидкость (200 г,
пл. 1,57 г/см3; tкип.= 75,3 оС), которую
можно получить при взаимодействии двух простых
желтоватых веществ. К полученному раствору при
перемешивании и охлаждении добавили 75 мл воды.
После расслоения реакционной смеси нижний слой
был отделен на делительной воронке, прогрет до 60
оС на водяной бане с вакуумированием. После
кристаллизации в вакуумном эксикаторе было
получено бесцветное кристаллическое вещество
(пл. 1,65 г/см3; tпл.= 74 оС) с выходом
90%.
Навеску полученного вещества массой 0,5986 г
растворили в воде. Объем раствора довели до 100
мл. На титрование аликвоты 10 мл полученного
раствора расходуется 7,3 мл 0,1 М раствора
гидроксида натрия при использовании в качестве
индикатора метилового красного (рН перехода
красный - желтый 4,2 - 6,2), а при использовании в
качестве индикатора фенолфталеина (рН перехода
8,0 - 9,6 бесцветный - малиновый) расходуется 14,6 мл 0,1
М раствора гидроксида натрия. Нейтральный (по
фенолфталеину) раствор дает белый осадок с
раствором хлорида бария, а с нитратом серебра
образующийся белый осадок достаточно быстро
темнеет.
- Определите состав синтезированного вещества
(формула), предложите его название.
- Какое строение имеет данное вещество
(графическая формула и геометрическое строение
- рисунок.)?
- Напишите уравнение реакции синтеза.
- Напишите уравнение реакции получения исходной
жидкости.
- Напишите уравнения реакций полученного
вещества с гидроксидом натрия, хлоридом бария,
нитратом серебра.
Задача 9-6.
"В чем же соль того завета…"
(Бахыт Кенжеев)
Рассмотрите перечень солей, представленных в
данной таблице:
| K2SO4 |
KHSO4 |
K2S2O7 |
K2CO3 |
KHCO3 |
KH2PO4 |
| K2HPO4 |
K4P2O7 |
K2SO3 |
K2S2O5 |
K2S |
KHS |
Константы диссоциации (Ка) некоторых
кислот представлены в следующей таблице:
кислота |
Ка |
рКа=–lgKa |
кислота |
Ka |
рКа=–lgKa |
| H2SO4 |
K2= 1,2 10-2 10-2 |
1,9 |
H2CO3 |
K1=4,45 10-7 10-7 |
6,35 |
| H2SO3 |
K1=1,58 10-2 10-2 |
1,8 |
|
K2=4,69 10-11 10-11 |
10,33 |
| |
K2=6,31 10-8 10-8 |
7,20 |
H3PO4 |
K1=7,52 10-3 10-3 |
2,12 |
| H2S |
K1=6 10-8 10-8 |
7,2 |
|
K2=6,31 10-8 10-8 |
7,20 |
| |
K2=1 10-14 10-14 |
14,0 |
|
K3=1,26 10-12 10-12 |
11,9 |
- Из первой таблице приведите примеры солей,
которые являются по составу: а) кислыми; б)
средними.
- Из первой таблицы приведите примеры солей,
водные растворы которых будут: а) нейтральными
(рН = 7 ± 1); б) щелочными; в) кислыми.
- Приведите уравнения реакций (в краткой ионной
форме), определяющих среду раствора.
- Рассчитайте массу и концентрацию (можно по
отдельным ионам) раствора, который образуется
при сливании 100 мл 1 М раствора K2CO3 и 50
мл 1 М раствора K2S2O7. (Плотности
растворов можно принять за 1,1 г/мл).
- Напишите уравнения реакций, происходящих при
добавлении раствора BaCl2 к растворам K2SO4;
KHSO4; K2S2O7; K2CO3;
KHCO3; K2HPO4.
- Приведите реакции взаимного превращения солей,
используя не более одного дополнительного
реактива (не приведенного в данном списке, вода
не учитывается) для групп: а) K2SO4, KHSO4,
K2S2O7; б) K2CO3, KHCO3;
в) KH2PO4, K2HPO4, K4P2O7.
Укажите условия проведения реакций (водный
раствор, расплав, температурные условия, …).
|