Сорокин
В.В., Загорский В.В., Свитанько И.В.Задачи химических олимпиад.
Определение формулы неизвестного вещества с использованием количественных данных
Ответы на задачи по теме:(задачи с 1-11)
Решения
Задача 1
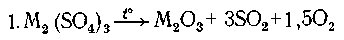
Пусть m - молекулярная масса металла, тогда:
(2m + 288 г) сульфата дают (2m + 48)г оксида,
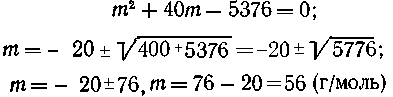
Этот элемент - железо.
Задача 2
2. Соли типа М2SО4 не
разлагаются; М2(SО3)3 не
существуют; расчет можно вести только с М2+.
MSO3 MO + SO2;
MO + SO2;
| М + 80 г сульфита
дают (М+16) г оксида, |
| 10,4 г сульфита - "-
-"--" у г -"- --"----"--" |
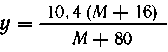
|
| М(ОН)2 = МО + Н2О; |
| (M + 34) г гидроксида дают (M +
16) г оксида, |
| 58 г гидроксида - "- - - -
-" - у г
- "- - -", |

|
Находим М = 24 г/моль, следовательно,
металл - магний.
Задача 3
3. Составим уравнение реакции:
xFе + yН2О = FехОу
+ yН2
Выделилось 0,8 г Н2, что составляет (0,8/2) = 0,4
моль. Количество воды, вступившей в реакцию,
также равно 0,4 моль, или 0,4 18 = 7,2 (г). По закону сохранения
массы суммарная масса нелетучего продукта
реакции составляет 16,8 + 7,2 - 0,8 = 23,2 г.
Следовательно, массовая доля железа в полученном
оксиде железа 16,8/23,2 = 0,724, или 72,4%.
18 = 7,2 (г). По закону сохранения
массы суммарная масса нелетучего продукта
реакции составляет 16,8 + 7,2 - 0,8 = 23,2 г.
Следовательно, массовая доля железа в полученном
оксиде железа 16,8/23,2 = 0,724, или 72,4%.
Проводя расчеты по формуле FexOy, определяем
состав оксида железа:
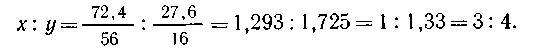
Искомая формула Fe3O4
Уравнение реакции: 3Fe + 4H2O = Fe3O4 +
4H2  (при
нагревании)
(при
нагревании)
Задача 4
4. Для схемы реакций, приведенной в
условии задачи, можно сделать следующие
обобщения. Из простых веществ (А) - металлов -
пригодны Li, Be, Mg, Ca (Na, К, Sr, Ba при горении образуют
пероксиды).
Из простых веществ (Б) - неметаллов - непригодны: а)
сера, так как при реакции SO2 (вещество Д) с
оксидом металла (вещество Г) образуется сульфит
(вещество Е), а при окислении сульфида (вещество В)
образуется сульфат; б) азот и углерод, так как в
нитриде и нитрате, карбиде и карбонате различное
соотношение металла и азота, а также металла и
углерода соответственно. Из неметаллов подходит,
например, фосфор. Тогда превращения,
соответствующие условию задачи, записываются
следующими уравнениями:
| 3Li |
+ Р = |
Li3Р, |
| А |
Б |
В |
| 4Li |
+O2 = |
2Li2O, |
|
|
Г |
| 4Р + |
5О2 = |
2Р2O5, |
|
|
Д |
| 3Li2O + |
Р2O5 = |
2Li3PO4 |
| Li3P + |
2O2 = |
Li3P04. |
|
|
Е |
Задача 5
5. Определяем молярную массу вещества,
содержащего 1 моль атомарного углерода: 12/0,0814 =
147,4 г/моль На кислород в полученном веществе
приходится 147,4 - 0,325 = 48 г. Очевидно, в составе
вещества имеется карбонат-ион СО3 2-.
В случае одновалентного металла его молярная
масса равна 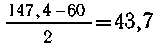 г/моль.
Такого металла нет.
г/моль.
Такого металла нет.
Если металл двухвалентный, его молярная масса
равна 147,4-60 = 87,4 г/моль. Металл -
стронций.Полученный продукт Г - SrCO3, тогда А
- SrO, Б - Н2О, В - Sr(OH)2. Уравнения реакций:
SrO + H2O = Sr(OH)2
Sr(OH)2 + CO2 = SrCO3 + H2O.
+ H2O.
Задача 6
6. Вещества: А - N2, Б - NH3, В - HNO3,
Г - NH4NO3, Д - N2O, Е - NaNH2, Ж - NaN3.
Уравнения реакций:
кат |
N2 + 3H2  2NH3; 2NH3; |
| 4NH3+5O2 = 4NO + 6H2O; |
| 2NO + O2 = 2NO2; |
| 4NO2 + O2 + 2H2O
= 4HNO3; |
| NH3 + HNO3 = NH4NO3; |
| NH4NO3 = N2O
+ 2H2O;(при to) |
| 2Na + 2NH3 = 2NaNH2 + H2; |
| NaNH2 + N2O = NaN3
+ 4 H2O. |
Массовая доля азота в NaN3 равна
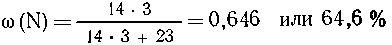 что подтверждает
условие задачи.
что подтверждает
условие задачи.
Задача 7
7. Порошок массой 9 г при
взаимодействии с водой образуют 22,4 л, или 1 моль
газа. Следовательно, первый порошок может
содержать гидрид щелочного металла (LiH). По
реакции
LiH + H2O = LiOH + H2
образуется 1 моль (22,4 л) водорода, следовательно,
реагирует 1 моль (8 г) LiH и образуется 1 моль LiOH.
Кроме того, порошок содержит 1 г вещества, что
составляет 1,0417-1=0,0417 (моль). Молярная масса этого
вещества равна 1/0,0417 = 24 (г/моль). Это может быть
гидроксид лития LiOH.
Второй порошок - дейтерид лития LiD, молярная масса
которого равна 9 г/моль:
|
|
|
22,4л |
|
LiD + Н2О |
= LiOH + |
HD. |
| M |
9 г/моль |
2 4 г/моль |
1 моль |
 |
|
1 моль |
|
Кроме того, возможно дополнительное решение:
второй порошок - смесь LiH и LIT в соотношении 1:1 или
смесь LiH и LiNH2 (в соотношении 14:1).
Задача 8
8. Смесь должна удовлетворять
следующим условиям: а) металл должен реагировать
с разбавленной серной кислотой, а его оксид -
полностью восстанавливаться водородом; б) металл
в оксиде дол-жень иметь большую положительную
степень окисления, чем в сульфате, полученном при
реакции металла с H2SO4.
Примеры смесей
1) Sn и SnO2.
SnO2 + 2H2 = Sn + 2H2O;
Sn + H2SO4 = SnSO4+ H2 .
.
Молярное соотношение 1:1.
2) Fe и Fe2O3.
Fe2O3 + 3H2 = 2Fe +3H2O;
Fe+ H2SO4 = FeSO4+ H2 .
.
1 моль Fе2О3 при восстановлении
образует 2 моль Fe, при растворении которых в H2SO4
образуется 2 моль Н2. 1 моль Fe при
растворении в H2SO4 образует 1 моль
водорода. Всего образуется 3 моль Н2.
Следовательно, молярное отношение металла и
оксида в смеси 1:1.
3) Fe и Fe3O4.
Fe3O4 + 4H2 = 3Fe + 4H2O;
Fe + H2SO4 = FeSO4 + H2
1 моль Fe3O4 образует 3 моль Fe,
3 моль Fe восстанавливают 3 моль H2 + H2SO4
Поэтому молярное отношение металла и оксида в
смеси 1:1.
Задача 9
9. Решение задачи ведем с конца: только
три монохлорпроизводных, значит, только три типа
атомов углерода в боковых цепях С6Нx(СН2)nСН3.
Соединений - два, типов С-атомов - три, значит, в
смеси присутствует толуол А (первый тип боковых
С-атомов) и еще одно органическое соединение Б -
гомолог толуола, дающий при окислении СO2
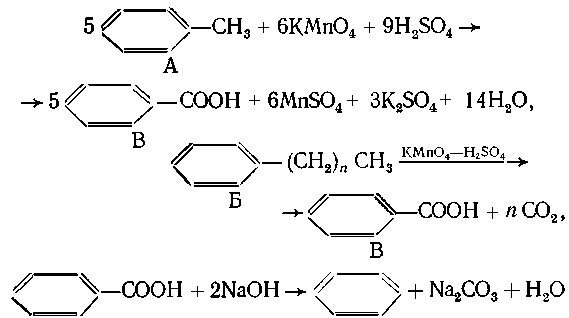
Из 1 моль толуола и 1 моль Б образуется 2 моль
бензойной кислоты, которую можно
декарбоксилировать 4 моль NaOH. Значит, на
поглощение СO2 потребовалось 0,24 4 = 1 моль щелочи:
4 = 1 моль щелочи:
NaOH + CO2  NaHCO3.
NaHCO3.
Таким образом, на 1 моль Б образуется 1 моль СО2 (n
=1), т. е. Б - этилбензол.
Задача 10
10. Необычность свойств раствора 1: щелочь +
соль Ag+  всегда есть осадок Ag2O; при разбавлении
водой дают осадок только аммиакаты галогенидов
серебра.
всегда есть осадок Ag2O; при разбавлении
водой дают осадок только аммиакаты галогенидов
серебра.
Подсчитайте молярную массу кислотного остатка А
осадка 1:
| На 46,2% Ва2+
приходится 53,8% А2- |
| на 137 г Ва2+ -"- - -
- "- - - -" х г А2- |
| х=160 |
Видимо, А = 2Вr-, т. е. соль - ВаВr2
(растворима в воде).
a) 2AgBr + Ba(NO3)2  2AgNO3 + BaBr2
2AgNO3 + BaBr2 .
.
57,4% Ag+ осадка 2 указывает на состав AgBr. Все
эти необычные факты наводят на мысль, что раствор
неводный. Но ведь в условии и не сказано, что он
водный! Факты, изложенные в условии задачи,
хорошо согласуются со свойствами аммиачных
комплексов серебра:
6)AgBrp-p + NaOH |
AgOHp-p + NaBr, |
|
(Ag(NH3)2OH) |
в) AgBrp-p + H2O  |
AgBr |
| (Ag(NH3)2Br) |
|
т. е. раствор 1 - это раствор AgBr в жидком аммиаке.
Задача 11
11. Из условия следует, что реакция в
первом электролизере прошла полностью:
|
анод |
катод |
BaCl2 + 2H2O  Ba(OH)2 Ba(OH)2 |
Cl2  |
+ H2  |
11,2 л Cl2 (0,5 моль) на аноде означает
образование 0,5 моль Ва(ОН)2 в растворе после
электролиза. Количество электричества во втором
электролизере такое же, т. е. там прошла реакция с
образованием 0,5 моль K2SO4:
K2SO3 + Н2О  K2SO4 + Н2
K2SO4 + Н2 .
.
При электролизе K2SO3 кислород не
выделяется, пока сульфит не окислится. При
смешении растворов выпадает осадок:
|
K2SO4 + |
Ba(OH)2 |
2КОН |
+ BaSO4 . |
 |
0,5 моль |
0,5 моль |
|
0,5 моль |
Таким образом, масса осадка составляет 117 г.


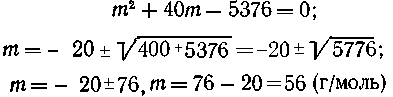
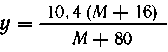
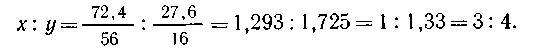
 2NH3;
2NH3;