|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
11. Активность электролитов
Переносчиками электрического тока в растворах
электролитов являются ионы, образующиеся при
диссоциации молекул электролитов. Поскольку при
диссоциации число частиц в растворе возрастает,
растворы электролитов обладают аномальными
коллигативными свойствами.
Уравнения, описывающие коллигативные свойства
неэлектролитов, можно применить и для описания
свойств идеальных растворов электролитов, если
ввести поправочный изотонический коэффициент
Вант-Гоффа i, например:
 осм. = iCRT или осм. = iCRT или  Tзам. = iKm. Tзам. = iKm.
Изотонический коэффициент связан со степенью
диссоциации  электролита:
электролита:
i = 1 +  (n - 1), (n - 1),
где n - количество ионов, образующихся при
диссоциации одной молекулы.
Свойства реальных растворов описываются
уравнениями, в которых вместо концентраций
вводится активность. Активность иона ai
выражается в виде произведения концентрации
иона mi на его коэффициент активности  i: i:
ai =  i mi. i mi.
Экспериментально определить активности
катиона a+ и аниона a-
невозможно, поэтому вводится понятие средней
ионной активности a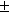 . Для
электролита, образующего n + катионов и n -
анионов, . Для
электролита, образующего n + катионов и n -
анионов,
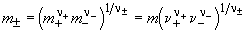 , ,
где n = n + + n -.
Аналогично определяют средний ионный
коэффициент активности  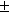
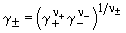
и среднюю ионную моляльность m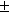
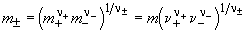 , ,
где 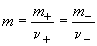 - моляльность
электролита. - моляльность
электролита.
Активность электролита определяется как
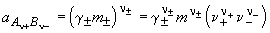
Согласно закону ионной силы, коэффициенты
активности ионов не зависят от конкретного вида
ионов, находящихся в растворе, а зависят от ионной
силы I раствора:
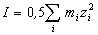 , ,
где zi - заряд иона (в единицах заряда
протона), mi - его моляльная
концентрация.
Согласно первому приближению теории Дебая-Хюккеля,
можно рассчитать как коэффициент активности  i отдельного иона i отдельного иона
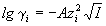 , ,
так и средний ионный коэффициент активности  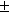 : :
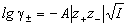 , ,
где z+ и z- заряды катиона и
аниона, I - ионная сила раствора, A -
константа, зависящая от диэлектрической
проницаемости растворителя и температуры. Для
водного раствора при 25o C A = 0.509.
ПРИМЕРЫ
Пример 11-1. Рассчитать активность электролита
a и среднюю ионную активность a в 0.1 m растворе CaCl2 при 25 o
C, если средний ионный коэффициент активности в 0.1 m растворе CaCl2 при 25 o
C, если средний ионный коэффициент активности   =
0.518. =
0.518.
Решение.
 , где n = n + + n - , где n = n + + n -
a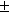 = 0.518. 0.1.(11
.22)1/3 = 8.223.10-2 = 0.518. 0.1.(11
.22)1/3 = 8.223.10-2
a(CaCl2) = (a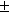 )n = 5.56.10-4 )n = 5.56.10-4
Ответ. a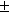 = 8.223.10-2;
a(CaCl2) = 5.56.10-4. = 8.223.10-2;
a(CaCl2) = 5.56.10-4.
Пример 11-2. Рассчитать моляльность раствора Na2SO4.
имеющего ионную силу 0.24 моль. кг-1.
Решение.
 , ,
где m1 и m2 - моляльности
катиона и аниона соли, равные соответственно m1
= 2m и
m2 = m, где m - моляльность раствора
Na2SO4. Отсюда
0.24 = 0.5 (2m.12 + m.22)
m = 0.08 моль.кг-1.
Ответ. m = 0.08 моль. кг-1.
Пример 11-3. Растворимость AgCl в воде при 25 o
C равна 1.274.10-5 моль. кг-1.
Рассчитать: а) стандартную энергию Гиббса для
реакции AgCl(тв)  Ag+ (aq)
+ Cl- (aq); б) растворимость AgCl в 0.020 моль.
кг-1 водном растворе K2SO4. Ag+ (aq)
+ Cl- (aq); б) растворимость AgCl в 0.020 моль.
кг-1 водном растворе K2SO4.
Решение. а) Константа равновесия для реакции
AgCl(тв)  Ag+ (aq) + Cl-
(aq) равна Ag+ (aq) + Cl-
(aq) равна
K = a(Ag+). a(Cl-). =  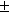 .
m2 .
m2
Ионная сила раствора
I = m = 1.274.10-5 моль. кг-1.
Тогда
lg  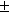 = -0.509. (1.274.10-5)0.5 = -1.82.10-3.
откуда = -0.509. (1.274.10-5)0.5 = -1.82.10-3.
откуда  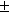 = 0.996 = 0.996
Следовательно
K = 0.9962 (1.274.10-5)2 = 1.61.10-10
Отсюда
 Go = -RTlnK
= +55.9 кДж. моль-1 Go = -RTlnK
= +55.9 кДж. моль-1
б) Ионная сила 0.020 моль. кг-1 раствора
K2SO4
I = 0.5 (2 0.020 12 + 0.020 22) = 0.060 моль.
кг-1.
Тогда
lg  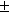 = -0.509. (0.060)0.5 = -0.12. откуда = -0.509. (0.060)0.5 = -0.12. откуда  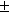 = 0.76 = 0.76
Растворимость AgCl
m = K0.5 /  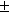 = (1.61.10-10)0.5 /
0.76 = 1.7.10-5 = (1.61.10-10)0.5 /
0.76 = 1.7.10-5
ЗАДАЧИ
11-1. Водный раствор, содержащий 0.225 моль.
кг-1 NaOH, замерзает при -0.667o C.
Определить кажущуюся степень диссоциации NaOH в
этом растворе, если криоскопическая константа
воды равна 1.86. (ответ)
11-2. Осмотическое давление крови
составляет 0.811 МПа. Какова должна быть
концентрация раствора NaCl, чтобы он был
изотоничен с кровью. Принять степень
диссоциации NaCl равной 0.950. (ответ)
11-3. Водные растворы сахарозы и KNO3
изотоничны при концентрациях 1.00 и 0.60 моль.
л-1 соответственно. Найти кажущуюся
степень диссоциации KNO3 в растворе. (ответ)
11-4. Вывести выражения для активности
NaCl, CaCl2. CuSO4 и LaCl3 через их
моляльности m и средние ионные коэффициенты
активности  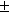 . (ответ) . (ответ)
11-5. Средний ионный коэффициент
активности 0.1 M водного раствора HCl при 25o C
равен 0.796. Рассчитать активность HCl в этом
растворе. (ответ)
11-6. Средний ионный коэффициент
активности 0.1 M водного раствора H2SO4
при 25o C равен 0.265. Рассчитать активность H2SO4
в растворе. (ответ)
11-7. Рассчитать активность электролита
a и среднюю ионную активность a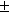 в 0.2 m растворе AlCl3 при 25 o
C, если в 0.2 m растворе AlCl3 при 25 o
C, если  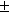 = 0.305. (ответ) = 0.305. (ответ)
11-8. Рассчитать ионную силу раствора,
содержащего 0.10 моль. кг-1 KCl и 0.20
моль. кг-1 CuSO4. (ответ)
11-9. Рассчитать ионную силу раствора,
содержащего 0.040 моль. кг-1 K3[Fe(CN)6],
0.030 моль. кг-1 KCl и 0.050 моль.
кг-1 NaBr.(ответ)
11-10. Рассчитать моляльность раствора
Al(NO3)3. имеющего ионную силу 0.30 моль.
кг-1. (ответ)
11-11. Раствор NaNO3 имеет ионную
силу 0.30 моль. кг-1. Чему равна
моляльность раствора Al2(SO4)3.
имеющего такую же ионную силу. (ответ)
11-12. Чему равна моляльность раствора Na3PO4.
имеющего такую же ионную силу, как 0.36 моль.
кг-1 раствор KCl? (ответ)
11-13. Рассчитать массу Ca(NO3)2,
которую нужно добавить к 0.150 моль. кг-1
раствору K NO3, содержащему 500 г воды, чтобы
увеличить его ионную силу до 0.250 моль. кг-1.
(ответ)
11-14. Используя первое приближение
теории Дебая-Хюккеля, рассчитать коэффициенты
активности ионов K+, Al3+ и SO42-
в 1.0. 10-3 моль. л-1
растворе KAl(SO4)2 при 25 o C. (ответ)
11-15. Используя первое приближение
теории Дебая-Хюккеля, рассчитать коэффициенты
активности ионов Ca2+, Cl- и средний
ионный коэффициент активности в 0.002 моль.
л-1 растворе CaCl2 при 25 o C. (ответ)
11-16. Используя первое приближение
теории Дебая-Хюккеля, рассчитать коэффициенты
активности ионов Ca2+, SO42- и
средний ионный коэффициент активности в 0.001 моль.
л-1 растворе CaSO4 при 25o C. (ответ)
11-17. Константа диссоциации уксусной
кислоты при 25o C равна 1.75. 10-5
моль. л-1. Используя первое
приближение теории Дебая-Хюккеля, рассчитать
степень диссоциации кислоты, если ее моляльность
равна 0.100 моль. кг-1. (ответ)
11-18. Средний ионный коэффициент
активности в 0.500 моль. кг-1 водном
растворе LaCl3 при 25 o C равен 0.303. Какова
ошибка в определении этой величины по первому
приближению теории Дебая-Хюккеля?(ответ)
11-19. Растворимость Ag2CrO4 в
воде при 25o C равна 8.00. 10-5
моль. л-1. а в 0.04 моль. л-1
растворе NaNO3 8.00. 10-5 моль.
л-1. Рассчитать средний ионный
коэффициент активности Ag2CrO4 в 0.04 моль.
л-1 растворе NaNO3. (ответ)
11-20. Растворимость AgCl в воде при 25 o
C равна 1.31.10-5 моль. л-1.
Рассчитать растворимость AgCl в 0.1 моль. кг-1
водном растворе KCl, в котором  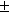 = 0.769. (ответ) = 0.769. (ответ)
|
