|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
3. Методы определения порядка реакции
Общий метод определения порядка реакции
основан на законе действующих масс:
 . (3.1) . (3.1)
Представим, что вещество B находится в большом
избытке, и его концентрация мало меняется в ходе
реакции. Тогда порядок реакции по веществу A
можно определить, измерив скорость реакции при
двух концентрациях A. Записывая уравнение (3.1) для
двух моментов времени в логарифмической форме и
вычитая одно выражение из другого, найдем
порядок x:
 . .
В случае, если имеется больше двух
экспериментальных точек, можно записать
кинетические данные в координатах lnw - ln[A] и
представить их в линейном виде с помощью метода
наименьших квадратов. Тогда порядок реакции x
будет равен тангенсу угла наклона прямой.
Если реакция имеет целый порядок, то для
определения порядка используют различные
частные методы. Метод подстановки
заключается в том, что кинетические данные
представляют в виде
kt = f([A]),
где функция f соответствует решению
кинетического уравнения для одного из целых
порядков. Если величина k, определенная таким
образом, будет постоянной, то мы угадали, т.е.
выбрали верный порядок. Если k будет
изменяться со временем, то надо выбрать функцию f,
соответствующую другому порядку.
Другой способ определения целого порядка
заключается в измерении зависимости времени
протекания реакции от начальной концентрации. Из
решения (2.1) кинетического уравнения для реакции n-го
порядка следует, что время t x, за
которое степень превращения достигнет x,
обратно пропорционально (n-1)-й степени
начальной концентрации (см. также (2.2)):
t x ~ a-(n-1).
Измеряя время превращения t x при двух
начальных концентрациях, можно определить
порядок n по формуле:
 . .
Отметим, что разные начальные концентрации
можно выбирать на одной и той же кинетической
кривой.
ПРИМЕРЫ
Пример 3-1. В некоторой реакции целого
порядка nA B концентрация исходного
вещества 0.5 моль/л была достигнута за 4 мин при
начальной концентрации 1 моль/л и за 5 мин при
начальной концентрации 2 моль/л. Установите
порядок реакции. B концентрация исходного
вещества 0.5 моль/л была достигнута за 4 мин при
начальной концентрации 1 моль/л и за 5 мин при
начальной концентрации 2 моль/л. Установите
порядок реакции.
Решение. Из первого опыта следует, что период
полураспада вещества при начальной концентрации
1 моль/л равен 4 мин. Во втором опыте при начальной
концентрации 2 моль/л период полураспада равен 1
мин (от 2 моль/л до 0.5 моль/л - за 5 мин, из них от 1
моль/л до 0.5 моль/л - 4 мин, следовательно на
превращение от 2 моль/л до 1 моль/л потребовалась 1
мин).
Таким образом, при увеличении начальной
концентрации в 2 раза период полураспада
уменьшился в 4 = 2n-1 раза, следовательно
порядок реакции n = 3.
Пример 3-2. Кинетика реакции первого порядка,
в которой происходило образование кислоты,
изучалась путем отбора проб реакционной смеси и
их титрования одним и тем же раствором щелочи.
Объемы щелочи, которые пошли на титрование:
Время, мин |
0 |
27 |
60 |

|
Объем, мл |
0 |
18.1 |
26.0 |
29.7 |
Докажите, что реакция имеет первый порядок.
Рассчитайте период полураспада.
Решение. Запишем решение кинетического
уравнения для реакции первого порядка в виде:
 , ,
где a = x = 29.7 мл. = 29.7 мл.
Время, мин |
0 |
27 |
60 |

|
k, мин-1 |
- |
0.0348 |
0.0347 |
- |
В течение реакции величина k остается
постоянной, что и доказывает первый порядок.
Период полураспада равен
 мин. мин.
Пример 3-3. Реакция омыления метилацетата
при 298 К описывается уравнением:
CH3COOCH3 + NaOH = CH3COONa + CH3OH.
Для этой реакции получены следующие
кинетические данные:
Время, мин |
3 |
5 |
7 |
10 |
15 |
25 |
сNaOH, ммоль/л |
7.40 |
6.34 |
5.50 |
4.64 |
3.63 |
2.54 |
Исходные концентрации щелочи и эфира одинаковы
и равны 0.01 моль/л. Определите порядок реакции и
константу скорости.
Решение. Запишем кинетические данные в
координатах lnw-lnсNaOH, причем
скорость реакции определим через конечные
изменения концентраций и времени:
 . .
(Концентрацию вещества иногда обозначают не
квадратными скобками, а буквой c). По этой
приближенной формуле скорость лучше определять
в середине временного интервала: t = (t1
+ t2)/2. Концентрацию в этот момент
времени определим как полусумму значений на
границах интервала: c = (c1 + c2)/2.
Сведем полученные данные в таблицу (учтем, что cNaOH
= 10 ммоль/л при t = 0):
t, мин |
1.5 |
4 |
6 |
8.5 |
12.5 |
20 |
сNaOH, ммоль/л |
8.70 |
6.87 |
5.92 |
5.07 |
4.13 |
3.08 |
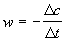 , ммоль/(л. мин) , ммоль/(л. мин)
|
0.867 |
0.530 |
0.420 |
0.287 |
0.202 |
0.109 |
ln w |
-0.143 |
-0.635 |
-0.868 |
-1.248 |
-1.599 |
-2.216 |
ln cNaOH |
2.16 |
1.93 |
1.78 |
1.62 |
1.42 |
1.12 |
График зависимости lnw-lnc представляет
собой прямую, описываемую уравнением y = -4.43 +
1.98x. Тангенс угла наклона прямой равен 1.98,
поэтому реакция имеет второй порядок.
Этот же вывод можно подтвердить методом
подстановки, представив экспериментальные
данные в виде решения кинетического уравнения
для реакции 2-го порядка с равными начальными
концентрациями:
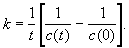
t, мин |
0 |
3 |
5 |
7 |
10 |
15 |
25 |
сNaOH, ммоль/л |
10 |
7.40 |
6.34 |
5.50 |
4.64 |
3.63 |
2.54 |
k, л/(ммоль. мин) |
- |
0.0117 |
0.0115 |
0.0117 |
0.0116 |
0.0117 |
0.0117 |
Средняя константа скорости k = 0.01165 л/(ммоль.
мин) = 11.65 л/(моль. мин).
ЗАДАЧИ
3-1. В некоторой реакции при изменении
начальной концентрации от 0.502 до 1.007 моль/л период
полураспада уменьшился с 51 до 26 с. Определите
порядок реакции и константу скорости. (ответ)
3-2. В некоторой реакции целого порядка nA B
концентрация исходного вещества 1.0 моль/л была
достигнута за 5.0 мин при начальной концентрации
3.0 моль/л и за 6.25 мин при начальной концентрации 6.0
моль/л. Установите порядок реакции.(ответ) B
концентрация исходного вещества 1.0 моль/л была
достигнута за 5.0 мин при начальной концентрации
3.0 моль/л и за 6.25 мин при начальной концентрации 6.0
моль/л. Установите порядок реакции.(ответ)
3-3. Реакция имеет целочисленный порядок.
Отношение времен превращения на кратную часть
равно t 1/2 / t 1/3 = 2. Определите порядок
реакции.(ответ)
3-4. В реакции A + B AB начальная скорость измерялась
при различных начальных концентрациях. Получены
следующие данные: AB начальная скорость измерялась
при различных начальных концентрациях. Получены
следующие данные:
[A]0, моль/л |
[B]0, моль/л |
w0, моль/(л. с) |
1.0 |
1.0 |
0.025 |
0.1 |
1.0 |
0.0025 |
1.0 |
0.1 |
0.00025 |
Напишите кинетическое уравнение реакции.(ответ)
3-5. В газофазной реакции A + B D скорость измерялась при
различных парциальных давлениях реагентов
(температура 300 К). Получены следующие данные: D скорость измерялась при
различных парциальных давлениях реагентов
(температура 300 К). Получены следующие данные:
N опыта |
pA, мм рт. ст. |
pB, мм рт. ст. |
w, моль/(л. с) |
1 |
4.0 |
15.0 |
2.59. 10-7 |
2 |
9.0 |
12.0 |
1.05. 10-6 |
3 |
13.0 |
9.0 |
1.64. 10-6 |
Определите порядки реакции по веществам А и В.(ответ)
3-6. Фенилдиазохлорид разлагается по
уравнению:
C6H5N2Cl = C6H5Cl
+ N2.
При температуре 323 К и начальной концентрации 10
г/л были получены следующие результаты:
t, мин |
6 |
9 |
12 |
14 |
18 |
22 |
24 |
26 |
30 |

|
 , см3 , см3
|
19.3 |
26.0 |
32.6 |
36.0 |
41.3 |
45.0 |
46.5 |
48.3 |
50.4 |
58.3 |
Определите порядок реакции и константу
скорости.(ответ)
3-7. При гомогенно-каталитическом разложении
перекиси водорода получены следующие данные:
t. 102, с |
0 |
5.00 |
8.40 |
12.84 |
19.50 |
31.08 |
39.30 |
[H2O2], моль/л |
0.350 |
0.227 |
0.160 |
0.110 |
0.061 |
0.025 |
0.0114 |
Определите порядок реакции и константу
скорости.(ответ)
3-8. Оксид азота (V) при 67 оС разлагается
по уравнению:
2N2O5(г) = 4NO2(г) +O2(г).
Зависимость концентрации реагента от времени
описывается следующими данными:
t, мин |
0 |
1 |
2 |
3 |
4 |
5 |
[N2O5], моль/л |
1.000 |
0.705 |
0.497 |
0.349 |
0.246 |
0.173 |
Определите порядок реакции, константу скорости
и время полураспада N2O5.(ответ)
3-9. Кинетику реакции 2A B, протекающей в жидкой фазе,
изучали спектрофотометрически и получили
следующие данные: B, протекающей в жидкой фазе,
изучали спектрофотометрически и получили
следующие данные:
t, мин |
0 |
10 |
20 |
30 |
40 |

|
[B], моль/л |
0 |
0.089 |
0.153 |
0.200 |
0.230 |
0.312 |
Определите порядок реакции и константу
скорости.(ответ)
3-10. Радикал ClO быстро распадается в
результате реакции:
2ClO = Cl2 +O2.
Были получены следующие кинетические данные:
t. 103, с |
0.12 |
0.62 |
0.96 |
1.60 |
3.20 |
4.00 |
5.75 |
[ClO]. 106,
моль/л |
8.49 |
8.09 |
7.10 |
5.79 |
5.20 |
4.77 |
3.95 |
Определите константу скорости данной реакции.(ответ)
3-11. Изучалась кинетика изомеризации цианата
аммония в мочевину:
NH4CNO (NH2)2CO. (NH2)2CO.
Цианат аммония массой 22.9 г растворили в воде и
объем раствора довели до 1.00 л. При измерении
содержания мочевины в растворе получены
следующие данные:
t, мин |
0 |
20.0 |
50.0 |
65.0 |
150 |
m(мочев.), г |
0 |
7.0 |
12.1 |
13.8 |
17.7 |
Определите порядок реакции и рассчитайте
константу скорости и массу цианата аммония через
300 мин после начала реакции.(ответ)
3-12. Определите порядок газофазной реакции A(г) B(г)
при 923 К, пользуясь зависимостью между временем
полураспада и давлением: B(г)
при 923 К, пользуясь зависимостью между временем
полураспада и давлением:
P, мм рт. ст. |
50 |
100 |
200 |
400 |
t 1/2, сек |
648 |
450 |
318 |
222 |
(ответ)
|

 .
. .
.