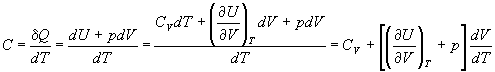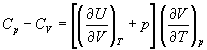|
Учебные материалы по физической химии
Задачи по физической химии.Часть 1.Химическая термодинамика
2. Первый закон термодинамики
Первый закон (первое начало) термодинамики -
это, фактически, закон сохранения энергии. Он
утверждает, что
энергия изолированной системы постоянна. В
неизолированной системе энергия может
изменяться за счет: а) совершения работы над
окружающей средой; б) теплообмена с окружающей
средой.
Для описания этих изменений вводят функцию
состояния - внутреннюю энергию U и две функции
перехода - теплоту Q и работу A.
Математическая формулировка первого закона:
dU =  Q - Q -  A (дифференциальная форма) (2.1)
A (дифференциальная форма) (2.1)
 U = Q - A
(интегральная форма) (2.2) U = Q - A
(интегральная форма) (2.2)
Буква  в уравнении (2.1)
отражает тот факт, что Q и A - функции
перехода и их бесконечно малое изменение не
является полным дифференциалом. в уравнении (2.1)
отражает тот факт, что Q и A - функции
перехода и их бесконечно малое изменение не
является полным дифференциалом.
В уравнениях (2.1) и (2.2) знаки теплоты и работы
выбраны следующим образом. Теплота считается
положительной, если она передается системе.
Напротив, работа считается положительной, если
она совершается системой над окружающей
средой.
Существуют разные виды работы: механическая,
электрическая, магнитная, поверхностная и др.
Бесконечно малую работу любого вида можно
представить как произведение обобщенной силы на
приращение обобщенной координаты, например:
 Aмех = p. dV; Aмех = p. dV;  Aэл = Aэл =  .
dе; .
dе;  Aпов = Aпов =  . dW (2.3) . dW (2.3)
( - электрический потенциал, e
- заряд, - электрический потенциал, e
- заряд,  - поверхностное
натяжение, W - площадь поверхности). С учетом (2.3),
дифференциальное выражение первого закона можно
представить в виде: - поверхностное
натяжение, W - площадь поверхности). С учетом (2.3),
дифференциальное выражение первого закона можно
представить в виде:
dU =  Q - p. dV Q - p. dV   Aнемех (2.4) Aнемех (2.4)
В дальнейшем изложении немеханическими видами
работы мы будем, по умолчанию, пренебрегать.
Механическую работу, производимую при
расширении против внешнего давления pex,
рассчитывают по формуле:
A = 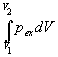 (2.5) (2.5)
Если процесс расширения обратим, то внешнее
давление отличается от давления системы
(например, газа) на бесконечно малую величину: pex
= pin - dp и в формулу (2.5) можно
подставлять давление самой системы, которое
определяется по уравнению состояния.
Проще всего рассчитывать работу, совершаемую
идеальным газом, для которого известно уравнение
состояния p = nRT / V (табл. 1).
Таблица 1. Работа идеального газа в некоторых
процессах расширения V1  V2:
V2:
Процесс |
A |
|
Расширение в вакуум
|
0 |
|
Расширение против постоянного внешнего
давления p
|
p (V2-V1) |
|
Изотермическое обратимое расширение
|
nRT ln(V2/V1) |
|
Адиабатическое обратимое расширение
|
nCV(T1-T2) |
При обратимом процессе совершаемая работа
максимальна.
Теплота может переходить в систему при
нагревании. Для расчета теплоты используют
понятие теплоемкости, которая определяется
следующим образом:
C = 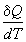 (2.6) (2.6)
Если нагревание происходит при постоянном
объеме или давлении, то теплоемкость обозначают
соответствующим нижним индексом:
CV = 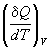 ; Cp
= ; Cp
= 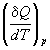 . (2.7) . (2.7)
Из определения (2.6) следует, что конечную
теплоту, полученную системой при нагревании,
можно рассчитать как интеграл:
Q = 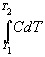 (2.8) (2.8)
Теплоемкость - экспериментально измеряемая
экстенсивная величина. В термодинамических
таблицах приведены значения теплоемкости при 298
К и коэффициенты, описывающие ее зависимость от
температуры. Для некоторых веществ теплоемкость
можно также оценить теоретически методами
статистической термодинамики (гл. 12). Так, при
комнатной температуре для одноатомных идеальных
газов мольная теплоемкость CV = 3/2 R,
для двухатомных газов CV = 5/2 R.
Теплоемкость определяется через теплоту,
переданную системе, однако ее можно связать и с
изменением внутренней энергии. Так, при
постоянном объеме механическая работа не
совершается и теплота равна изменению
внутренней энергии:  QV
= dU, поэтому QV
= dU, поэтому
CV = 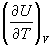 . (2.9) . (2.9)
При постоянном давлении теплота равна
изменению другой функции состояния, которую
называют энтальпией:
 Qp = dU + pdV = d
(U+pV) = dH, (2.10) Qp = dU + pdV = d
(U+pV) = dH, (2.10)
где H = U+pV - энтальпия системы. Из
(2.10) следует, что теплоемкость Cp
определяет зависимость энтальпии от
температуры.
Cp = 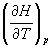 . (2.11) . (2.11)
Из соотношения между внутренней энергией и
энтальпией следует, что для моля идеального газа
Cp - CV = R. (2.12)
Внутреннюю энергию можно рассматривать, как
функцию температуры и объема:
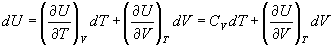 (2.13) (2.13)
Для идеального газа экспериментально
обнаружено, что внутренняя энергия не зависит от
объема, 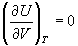 , откуда можно
получить калорическое уравнение состояния: , откуда можно
получить калорическое уравнение состояния:
dU = CV dT,
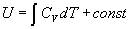 (2.14) (2.14)
В изотермических процессах с участием
идеального газа внутренняя энергия не
изменяется, и работа расширения происходит
только за счет поглощаемой теплоты.
Возможен и совсем иной процесс. Если в течение
процесса отсутствует теплообмен с окружающей
средой ( Q = 0), то такой
процесс называют адиабатическим. В
адиабатическом процессе работа может
совершаться только за счет убыли внутренней
энергии. Работа обратимого адиабатического
расширения идеального газа: Q = 0), то такой
процесс называют адиабатическим. В
адиабатическом процессе работа может
совершаться только за счет убыли внутренней
энергии. Работа обратимого адиабатического
расширения идеального газа:
A = - U = nCV (T1-T2)
(2.15) U = nCV (T1-T2)
(2.15)
(n - число молей, CV - мольная
теплоемкость). Эту работу можно также выразить
через начальные и конечные давление и объем:
A = 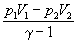 (2.16) (2.16)
где  = Cp / CV. = Cp / CV.
При обратимом адиабатическом расширении
идеального газа давление и объем связаны
соотношением (уравнением адиабаты):
pV  = const. (2.17) = const. (2.17)
В уравнении (2.17) важны два момента: во-первых,
это уравнение процесса, а не уравнение состояния;
во-вторых, оно справедливо только для
обратимого адиабатического процесса. Это же
уравнение можно записать в эквивалентном виде:
TV  -1 = const, (2.18) -1 = const, (2.18)
T  p1- p1- = const. (2.19) = const. (2.19)
ПРИМЕРЫ
Пример 2-1. Рассчитайте изменение внутренней
энергии гелия (одноатомный идеальный газ) при
изобарном расширении от 5 до 10 л под давлением 196
кПа.
Решение. p1 = p2 = 196 кПа, V1
= 5 л, V2 = 10 л. Начальная и конечная
температуры: T1 = p1V1 / nR,
T2 = p2V2 / nR.
Изменение внутренней энергии идеального газа
определяется только начальной и конечной
температурой (CV = 3/2 nR - идеальный
одноатомный газ):
 U = CV (T2-T1)
= 3/2 nR (T2-T1) = 3/2 (p2V2
- p1V1) = 3/2 U = CV (T2-T1)
= 3/2 nR (T2-T1) = 3/2 (p2V2
- p1V1) = 3/2  (196.
103) (196.
103) (10-5). 10-3 = (10-5). 10-3 =
= 1470 Дж.
Ответ. 1470 Дж.
Пример 2-2. Используя первый закон и
определение теплоемкости, найдите разность
изобарной и изохорной теплоемкостей для
произвольной термодинамической системы.
Решение. В определение теплоемкости (2.6)
подставим дифференциальное представление
первого закона (2.1) и используем соотношение (2.13)
для внутренней энергии как функции температуры и
объема:
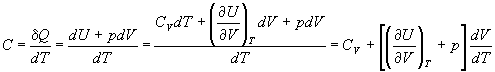
Отсюда при постоянном давлении получаем:
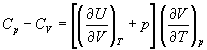
Пример 2-3. Один моль ксенона, находящийся при
25 оС и 2 атм, расширяется адиабатически: а)
обратимо до 1 атм, б) против давления 1 атм. Какой
будет конечная температура в каждом случае?
Решение. а) Исходный объем ксенона (n = 1):
V1 = nRT1 / p1 = 0.082.
298 / 2 = 12.2 л.
Конечный объем можно найти из уравнения
адиабаты (для одноатомного идеального газа  = Cp / CV = 5/3): = Cp / CV = 5/3):
p1V15/3 = p2V25/3
V2 = V1 . (p1/p2)3/5
= 12.2 . 23/5 = 18.5 л.
Конечную температуру находим по уравнению
состояния идеального газа (p2 = 1 атм):
T2 = p2V2 / nR = 18.5 /
0.082 = 225 К.
б) При необратимом расширении против
постоянного внешнего давления уравнение
адиабаты неприменимо, поэтому надо
воспользоваться первым законом термодинамики.
Работа совершается за счет убыли внутренней
энергии:
A = - U = nCV (T1-T2), U = nCV (T1-T2),
где n = 1, CV = 3/2 R (одноатомный
идеальный газ). Работа расширения против
постоянного внешнего давления p2 равна:
A = p2 (V2-V1) = nRT2
- p2V1.
Приравнивая последние два выражения, находим
температуру T2:
T2 = (nCVT1 + p2V1)
/ (nCV + nR) = 238 К.
Температура выше, чем при обратимом расширении,
т.к. в обратимом случае совершается бМльшая
работа, расходуется больше внутренней энергии и
температура понижается на большую величину.
Ответ. а) 225 К; б) 238 К.
Пример 2-4. Один моль водяных паров обратимо
и изотермически сконденсировали в жидкость при
100 оС. Рассчитайте работу, теплоту,
изменение внутренней энергии и энтальпии в этом
процессе. Удельная теплота испарения воды при 100 оС
равна 2260 Дж/г.
Решение. В процессе
H2O(г)  H2O(ж) H2O(ж)
произошло обратимое сжатие газа при постоянном
давлении p = 1 атм от объема V1 = nRT /
p = 0.082. 373 = 30.6 л до объема одного моля
жидкой воды V2 ~ 0.018 л. Работа сжатия при
постоянном давлении равна:
A = p (V2-V1)  -pV1 = -101.3 кПа -pV1 = -101.3 кПа  30.6 л = -3100 Дж. 30.6 л = -3100 Дж.
При испарении одного моля воды затрачивается
теплота 2260 Дж/г  18 г = 40700 Дж,
поэтому при конденсации одного моля воды эта
теплота, напротив, выделяется в окружающую среду: 18 г = 40700 Дж,
поэтому при конденсации одного моля воды эта
теплота, напротив, выделяется в окружающую среду:
Q = -40700 Дж.
Изменение внутренней энергии можно рассчитать
по первому закону:
 U = Q - A = -40700 - (-3100) =
-37600 Дж, U = Q - A = -40700 - (-3100) =
-37600 Дж,
а изменение энтальпии - через изменение
внутренней энергии:
 H = H =  U + U +
 (pV) = (pV) =  U +
p U +
p V = V =  U + A
= Q = -40700 Дж. U + A
= Q = -40700 Дж.
Изменение энтальпии равно теплоте, т.к. процесс
происходит при постоянном давлении.
Ответ. A = -3100 Дж, Q =  H
= -40700 Дж, H
= -40700 Дж,  U = -37600 Дж. U = -37600 Дж.
ЗАДАЧИ
2-1. Газ, расширяясь от 10 до 16 л при постоянном
давлении 101.3 кПа, поглощает 126 Дж теплоты.
Определите изменение внутренней энергии газа.
2-2. Определите изменение внутренней энергии,
количество теплоты и работу, совершаемую при
обратимом изотермическом расширении азота от 0.5
до 4 м3 (начальные условия: температура 26.8 оС,
давление 93.2 кПа).
2-3. Один моль идеального газа, взятого при 25 oC
и 100 атм, расширяется обратимо и изотермически до
5 атм. Рассчитайте работу, поглощенную теплоту,  U и U и  H. H.
2-4. Рассчитайте изменение энтальпии
кислорода (идеальный газ) при изобарном
расширении от 80 до 200 л при нормальном
атмосферном давлении.
2-5. Какое количество теплоты необходимо для
повышения температуры 16 г кислорода от 300 до 500 К
при давлении 1 атм? Как при этом изменится
внутренняя энергия?
2-6. Объясните, почему для любой
термодинамической системы Cp > CV.
2-7. Чайник, содержащий 1 кг кипящей воды,
нагревают до полного испарения при нормальном
давлении. Определите A, Q,  U,
U,  H для этого процесса.
Мольная теплота испарения воды 40.6 кДж/моль. H для этого процесса.
Мольная теплота испарения воды 40.6 кДж/моль.
2-8. Определите конечную температуру и работу,
необходимую для адиабатического сжатия азота от
10 л до 1 л, если начальные температура и давление
равны 26.8 оС и 101.3 кПа, соответственно.
2-9. Три моля идеального одноатомного газа (CV
= 3.0 кал/(моль. К)), находящегося при T1
= 350 K и P1 = 5 атм, обратимо и адиабатически
расширяются до давления P2 = 1 атм.
Рассчитайте конечные температуру и объем, а
также совершенную работу и изменение внутренней
энергии и энтальпии в этом процессе.
2-10. Система содержит 0.5 моль идеального
одноатомного газа (CV = 3.0 кал/(моль.
К)) при P1 = 10 атм и V1 = 1 л. Газ
расширяется обратимо и адиабатически до
давления P2 = 1 атм. Рассчитайте
начальную и конечную температуру, конечный
объем, совершенную работу, а также изменение
внутренней энергии и энтальпии в этом процессе.
Рассчитайте эти величины для соответствующего
изотермического процесса.
2-11. Рассчитайте количество теплоты,
необходимое для нагревания воздуха в квартире
общим объемом 600 м3 от 20 оС до 25 оС.
Примите, что воздух - это идеальный двухатомный
газ, а давление при исходной температуре
нормальное. Найдите  U и U и  H для процесса нагревания
воздуха. H для процесса нагревания
воздуха.
2-12. Человеческий организм в среднем выделяет
104 кДж в день благодаря метаболическим
процессам. Основной механизм потери этой энергии
- испарение воды. Какую массу воды должен
ежедневно испарять организм для поддержания
постоянной температуры? Удельная теплота
испарения воды - 2260 Дж/г. На сколько градусов
повысилась бы температура тела, если бы организм
был изолированной системой? Примите, что средняя
масса человека - 65 кг, а теплоемкость равна
теплоемкости жидкой воды.
2-13. Один моль паров брома обратимо и
изотермически сконденсировали в жидкость при 59 оС.
Рассчитайте работу, теплоту, изменение
внутренней энергии и энтальпии в этом процессе.
Удельная теплота испарения брома при 59 оС
равна 184.1 Дж/г.
2-14. Один моль идеального одноатомного газа
вступает в следующий замкнутый цикл:

Процесс 1  2 - изотермический, 3 2 - изотермический, 3  1 - адиабатический. Рассчитайте
объемы состояний 2 и 3, а также температуры
состояний 1, 2 и 3, считая стадии 1 1 - адиабатический. Рассчитайте
объемы состояний 2 и 3, а также температуры
состояний 1, 2 и 3, считая стадии 1  2
и 3 2
и 3  1 обратимыми. Рассчитайте 1 обратимыми. Рассчитайте  U и U и  H для
каждой стадии. H для
каждой стадии.
2-15. Придумайте циклический процесс с
идеальным газом, состоящий из четырех стадий.
Изобразите этот процесс в координатах p - V.
Рассчитайте полное изменение внутренней
энергии, а также теплоту и совершенную газом
работу.
2-16. Один моль фтороуглерода расширяется
обратимо и адиабатически вдвое по объему, при
этом температура падает от 298.15 до 248.44 К. Чему
равно значение CV?
2-17. Докажите соотношение (2.16) для работы
обратимого адиабатического процесса.
2-18. Один моль метана, взятый при 25 оС и 1
атм, нагрет при постоянном давлении до удвоения
объема. Мольная теплоемкость метана дается
выражением:
Cp = 5.34 + 0.0115. T кал/(моль.
К).
Рассчитайте  U и U и  H для этого процесса. Метан
можно считать идеальным газом. H для этого процесса. Метан
можно считать идеальным газом.
2-19. Выведите уравнение для обратимого
адиабатического сжатия неидеального газа, если
уравнение состояния одного моля газа имеет вид:
p (V-b) = RT.
2-20*. Используя уравнение состояния и первый
закон термодинамики, выведите уравнение
адиабаты для газа Ван-дер-Ваальса.
|

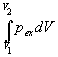 (2.5)
(2.5)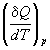 . (2.7)
. (2.7)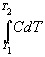 (2.8)
(2.8)