|
Учебные материалы по физической химии
Задачи по физической химии.Часть 1.Химическая термодинамика
Глава 2. Приложения химической
термодинамики
6. Фазовое равновесие в
однокомпонентных системах
Условием равновесия между двумя фазами
является равенство давления, температуры и
химических потенциалов (мольных энергий Гиббса)
в обеих фазах. Если температура изменяется при
постоянном давлении или давление изменяется при
постоянной температуре, то равновесие
нарушается и одна из фаз исчезает. Изменение
химических потенциалов фаз при этом можно
рассчитать по уравнениям:
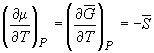 , (6.1) , (6.1)
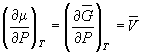 , (6.2) , (6.2)
где 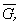 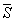 и и 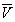 – мольные
энергия Гиббса, энтропия и объем. – мольные
энергия Гиббса, энтропия и объем.
Условие сосуществования двух фаз при
одновременном изменении давления P и
температуры T описывается уравнением
Клапейрона:
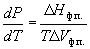 , (6.3) , (6.3)
где  Hф.п. – мольная
энтальпия равновесного фазового перехода
(плавление, испарение, возгонка, переход между
модификациями), Hф.п. – мольная
энтальпия равновесного фазового перехода
(плавление, испарение, возгонка, переход между
модификациями),  Vф.п. – разность
мольных объемов фаз, находящихся в равновесии. Vф.п. – разность
мольных объемов фаз, находящихся в равновесии.
В случаях испарения и возгонки уравнение (6.3)
можно упростить, считая, что мольным объемом
конденсированной фазы (жидкости или твердого
тела) Vк.ф. по сравнению с мольным
объемом пара Vпар можно пренебречь и
что пар подчиняется уравнению состояния
идеального газа. Подставляя (Vпар – Vк.ф.)
 Vпар и Vпар
= RT/P, получаем уравнение
Клаузиуса-Клапейрона: Vпар и Vпар
= RT/P, получаем уравнение
Клаузиуса-Клапейрона:
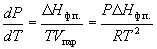 (6.4) (6.4)
или после преобразования
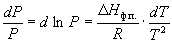 . (6.5) . (6.5)
Интегрирование в предположении, что  Hф.п.
не зависит от температуры (что справедливо в
узких интервалах температур), дает Hф.п.
не зависит от температуры (что справедливо в
узких интервалах температур), дает
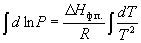 (6.6) (6.6)
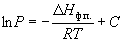 (6.7) (6.7)
где C – константа интегрирования.
Следовательно, зависимость lnP от 1/Т
должна быть линейной, а наклон прямой равен –  Hф.п./R. Hф.п./R.
Интегрирование в пределах P1, P2,
и T1, T2 дает:
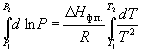 (6.8) (6.8)
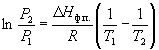 (6.9) (6.9)
По этому уравнению можно рассчитать энтальпию
испарения или возгонки, исходя из значений
давления пара при двух разных температурах.
Мольные энтальпии возгонки, плавления и
испарения при данной температуре связаны
соотношением
 возгH
= возгH
=  плH
+ плH
+  испH
(6.10) испH
(6.10)
Энтальпию испарения жидкости можно
приближенно оценить по правилу Трутона,
согласно которому мольная энтропия испарения в
нормальной точке кипения (при 1 атм)
приблизительно постоянна:
 испS
= испS
= 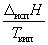  88 Дж. моль–1. К–1
(6.11) 88 Дж. моль–1. К–1
(6.11)
Правило хорошо выполняется для неполярных
жидкостей.
Зависимость энтальпии фазового перехода от
температуры можно рассчитать по закону
Кирхгофа:
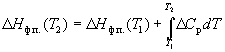 (6.12) (6.12)
или
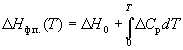 (6.13) (6.13)
где  Cp – разность
теплоемкостей фаз, находящихся в равновесии, Cp – разность
теплоемкостей фаз, находящихся в равновесии,  H0
– константа интегрирования, определяемая из
известных значений H0
– константа интегрирования, определяемая из
известных значений  Hф.п. и Hф.п. и  Cp. Для
небольших интервалов температуры можно считать,
что Cp. Для
небольших интервалов температуры можно считать,
что  Cp = const. В этом случае из
уравнения (6.13) получаем: Cp = const. В этом случае из
уравнения (6.13) получаем:
 Hф.п. (T) = Hф.п. (T) =  H0
+ T H0
+ T  Cp. (6.14) Cp. (6.14)
Подставляя уравнение (6.14) в уравнение (6.7),
получаем:
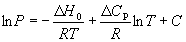 , (6.15) , (6.15)
в котором С определяют из известных
значений P,  H0 и H0 и  Cp. Cp.
ПРИМЕРЫ
Пример 6-1. Рассчитать изменение давления,
необходимое для изменения температуры плавления
льда на 1o C. При 0o C энтальпия
плавления льда равна 333.5 Дж. г–1,
удельные объемы жидкой воды и льда равны Vж.
= 1.0002 см3. г–1 и Vтв. =
1.0908 см3. г–1.
Решение. Изменение объема при плавлении льда
равно
Vж. – Vтв. = 1.0002 – 1.0908 = –0.0906 см3.
г–1 = –9.06 10–8
м3. г–1. 10–8
м3. г–1.
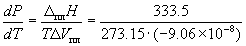 = –1.348 = –1.348 107 (Па. К–1) = –133 атм.
К–1. 107 (Па. К–1) = –133 атм.
К–1.
Таким образом, при повышении давления на 133 атм
температура плавления льда понижается на 1
градус. Знак "минус" показывает, что при
повышении давления температура плавления
понижается.
Ответ.  P = 133
атм. P = 133
атм.
Пример 6-2. Рассчитать давление пара жидкого
брома при 25o C.  fGo газообразного брома равна 3.110
кДж. моль–1.
fGo газообразного брома равна 3.110
кДж. моль–1.
Решение.  испGo
брома равно испGo
брома равно  fGo
[Br2 (г)] = 3110 Дж. моль–1. fGo
[Br2 (г)] = 3110 Дж. моль–1.
 испGo
= испGo
= 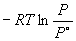 , откуда P = 0.2852
атм. , откуда P = 0.2852
атм.
Ответ. P = 0.2852 атм.
Пример 6-3. Рассчитать давление, при котором
графит и алмаз находятся в равновесии при 25o
C.  fGo алмаза
равна 2.900 кДж. моль–1. Считать
плотности графита и алмаза равными 2.25 и 3.51 г.
см–3 соответственно и не зависящими от
давления. fGo алмаза
равна 2.900 кДж. моль–1. Считать
плотности графита и алмаза равными 2.25 и 3.51 г.
см–3 соответственно и не зависящими от
давления.
Решение. Изменение объема при переходе от
графита к алмазу равно
 V = 12. V = 12. 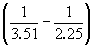  10–6 = –1.91 10–6 = –1.91 10–6 м3. моль–1
10–6 м3. моль–1
При начальном давлении P1 разность
мольных энергий Гиббса  G1 = 2900 Дж. моль–1, а
при конечном давлении P2 разность G1 = 2900 Дж. моль–1, а
при конечном давлении P2 разность  G2 =0. G2 =0.
Поскольку 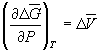 , то , то 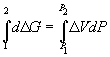 = =  G2 – G2 –  G1 = G1 =  V(P2
– P1). V(P2
– P1).
Отсюда P2 = 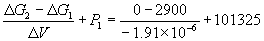 =
1.52 =
1.52 109 Па = 1.5 109 Па = 1.5 104 атм. 104 атм.
Ответ. P = 1.5 104
атм. 104
атм.
Пример 6-4. Температура кипения бензола при
давлении 1 атм равна 80.1o C. Оценить давление
пара бензола при 25o C.
Решение. Давление пара бензола при T1
= 353.3 K равно P1 = 1 атм. По правилу Трутона  испH = 88.
353.3 = 31.1 кДж. моль–1. Подставим эти
данные в уравнение (6.9). Получим: испH = 88.
353.3 = 31.1 кДж. моль–1. Подставим эти
данные в уравнение (6.9). Получим:
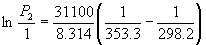 , откуда P2 =
0.141 атм. , откуда P2 =
0.141 атм.
Ответ. P = 0.141 атм.
ЗАДАЧИ
- Рассчитать давление, при котором две формы CaCO3
– кальцит и арагонит – находятся в равновесии
при 25o C.
 fGo
кальцита и арагонита при 25o C равны –1128.79
и –1127.75 кДж. моль–1 соответственно.
Считать, что плотности кальцита и арагонита
равны 2.71 и 2.93 г. см–3 соответственно и
не зависят от давления. fGo
кальцита и арагонита при 25o C равны –1128.79
и –1127.75 кДж. моль–1 соответственно.
Считать, что плотности кальцита и арагонита
равны 2.71 и 2.93 г. см–3 соответственно и
не зависят от давления.
- Рассчитать температуру, при которой две формы
CaCO3 – кальцит и арагонит – находятся в
равновесии при давлении 1 атм. При 25o C
 fGo кальцита
и арагонита равны –1128.79 и –1127.75 кДж. моль–1
соответственно, fGo кальцита
и арагонита равны –1128.79 и –1127.75 кДж. моль–1
соответственно,  fHo
равны–1206.92 и –1207.13 кДж. моль–1
соответственно. Считать, что fHo
равны–1206.92 и –1207.13 кДж. моль–1
соответственно. Считать, что  CP = 0. CP = 0.
 fGo жидкой
и газообразной воды при 25o C равны –237.129 и
–228.572 кДж. моль–1 соответственно.
Рассчитать давление пара воды при 25o C. fGo жидкой
и газообразной воды при 25o C равны –237.129 и
–228.572 кДж. моль–1 соответственно.
Рассчитать давление пара воды при 25o C.- Плотности жидкого и твердого олова при
температуре плавления (231.9o C) равны 6.980 г.
см–3 и 7.184 г. см–3
соответственно. Энтальпия плавления олова равна
1.690 ккал. моль–1. Определить
температуру плавления олова под давлением 500 атм.
Молярная масса олова равна 118.7 г. моль–1.
- При замерзании бензола (5.5oC) его плотность
изменяется от 0.879 г. см–3 до 0.891 г.
см–3. Энтальпия плавления равна 10.59 кДж.
моль–1. Определить температуру плавления
бензола при давлении 1000 атм.
- Плотности жидкой и твердой ртути при
температуре плавления
(–38.87oC) равны 13.690 и 14.193 г. см–3
соответственно. Энтальпия плавления ртути равна
2.33 кал. г–1. Определить температуру
плавления ртути при давлении 3000 атм.
- Температура кипения жидкого метанола равна 34.7 o
C при давлении 200 мм рт. ст. и 49.9 o C при
давлении 400 мм рт. ст. Найти температуру кипения
метанола при нормальном давлении.
- Давление пара диэтилового эфира при 10o C
равно 286.8 мм рт. ст., а при 20o C – 432.8 мм рт. ст.
Определить мольную энтальпию испарения и
нормальную температуру кипения эфира.
- Давление пара дихлорметана при 24.1oC равно
400 Торр, а его энтальпия испарения равна 28.7 кДж.
моль–1. Рассчитать температуру, при
которой давление пара будет равно 500 Торр.
- Давление пара твердого CO2 равно 133 Па при
–134.3 o C и 2660 Па при –114.4 o C. Рассчитать
энтальпию возгонки.
- Давление пара (Торр) жидкости в интервале
температур 200 – 260 K описывается уравнением:
ln p = 16.255 – 2501.8 / T.
Рассчитать энтальпию испарения и нормальную
точку кипения жидкости.
- Давление пара (Торр) жидкого бензола C6H6
между 10oC и 80oC описывается уравнением:
lg p = 7.960 – 1780 / T.
Рассчитать энтальпию испарения и нормальную
точку кипения бензола.
- Давление пара жидкого нафталина C10H8
равно 10 Торр при 85.8oC и 40 Торр при 119.3oC.
Определить энтальпию испарения, нормальную
точку кипения и энтропию испарения в нормальной
точке кипения.
- Нормальная точка кипения гексана равна 69.0єC.
Оценить а) мольную энтальпию испарения и б)
давление пара гексана при 25єC и 60єC.
- При 0oC энтальпии испарения и плавления
воды равны 595 и 79.7 кал. г–1
соответственно. Давление пара воды при 0oC
равно 4.58 мм рт. ст. Рассчитать давление пара льда
при –15oC, считая, что изменение энтальпии не
зависит от температуры.
- Рассчитать температуру кипения воды на вершине
Эвереста (высота 8850 м). Энтальпию испарения воды
считать равной 40.67 кДж. моль–1. Для
расчета атмосферного давления на вершине
воспользоваться барометрической формулой.
- Уксусная кислота имеет следующие давления
насыщенного пара:
| T, K |
363 |
383 |
403 |
| P, мм. рт. ст. |
293 |
583 |
1040 |
Определить молярную массу уксусной
кислоты в паре, если известно, что "испH
= 24.35 кДж. моль–1.
- Давление пара (в мм рт. ст.) твердого и жидкого SO2
выражается уравнениями
lg P(тв) = 10.5916 – 1871.2/T
lg P(ж) = 8.3186 – 1425.7/T
Рассчитать температуру, давление и  плH SO2
в тройной точке. плH SO2
в тройной точке.
- Давление пара (в мм рт. ст.) над твердым и жидким UF6
выражается уравнениями
lg P(тв) = 10.648 – 2559.5/T
lg P(ж) = 7.540 – 1511.3/T
Рассчитать температуру, давление и  плH UF6
в тройной точке. плH UF6
в тройной точке.
- Давление пара над твердым Cl2 равно 352 Па
при –112oC и 35 Па при –126.5oC, а давление
пара над жидким Cl2 равно 1590 Па при –100oC
и 7830 Па при –80oC. Определить координаты
тройной точки и
 плH
Cl2. плH
Cl2.
- Давление пара над твердым C6H6 равно
299 Па при –30oC и 3270 Па при 0oC, а давление
пара над жидким C6H6 равно 6170 Па при 10oC
и 15800 Па при 30oC. Определить координаты
тройной точки и
 плH
C6H6. плH
C6H6.
- Давление пара над твердым SnBr4 равно 0.116 мм
рт. ст. при 9.8 oC и 0.321 мм рт. ст. при 21.0 oC,
а давление пара над жидким SnBr4 равно 0.764 мм
рт. ст. при 30.7 oC и 1.493 мм рт. ст. при 41.4 oC.
Определить координаты тройной точки и
 плH SnBr4. плH SnBr4.
- Давление пара 2,2-диметилбутанола-1 (мм рт. ст.)
выражается уравнением:
lg p = –4849.3/T – 14.701 lgT + 53.1187.
Рассчитать а) нормальную точку кипения, б)
энтальпию испарения в нормальной точке кипения,
в) энтальпию испарения при 25o C.
- Давление пара ртути (мм рт. ст.) в интервале 298 –
630 К выражается уравнением:
lg p = –3308/T – 0.8 lgT + 10.373.
Рассчитать а) нормальную точку кипения ртути и
б) энтальпию испарения ртути в нормальной точке
кипения.
- Рассчитать давление пара воды при 200o C,
принимая, что а)
 Hисп
= 40.67 кДж. моль–1 и не зависит от
температуры; б) Hисп
= 40.67 кДж. моль–1 и не зависит от
температуры; б)  Cp
= –42 Дж. моль–1. К–1. Cp
= –42 Дж. моль–1. К–1.
|

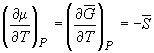 , (6.1)
, (6.1)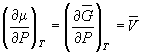 , (6.2)
, (6.2)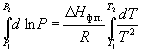 (6.8)
(6.8)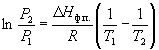 (6.9)
(6.9)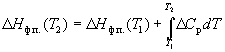 (6.12)
(6.12)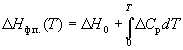 (6.13)
(6.13)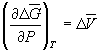 , то
, то 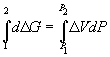 =
=