|
Учебные материалы по физической химии
Задачи по физической химии.Часть 1.Химическая термодинамика
Биологический факультет
Экзамен по физической химии (3-й семестр)
1. Определите конечную температуру и работу,
необходимую для обратимого адиабатического
сжатия криптона (идеальный газ) от 100 л до 30 л, если
начальные температура и давление равны 15 оС
и 105 Па, соответственно.
2. Найдите  rH0
реакции rH0
реакции
CH4 + Cl2 = CH3Cl(г) + HCl(г),
если известны теплоты сгорания метана ( cH0(CH4) = –890.3
кДж/моль), хлорметана ( cH0(CH4) = –890.3
кДж/моль), хлорметана ( cH0(CH3Cl)
= –689.1 кДж/моль), водорода ( cH0(CH3Cl)
= –689.1 кДж/моль), водорода ( cH0(H2)
= –285.8 кДж/моль) и теплота образования HCl ( cH0(H2)
= –285.8 кДж/моль) и теплота образования HCl ( fH0(HCl) = –92.3
кДж/моль)). fH0(HCl) = –92.3
кДж/моль)).
3. Определите зависимость энтропии от объема
для термодинамической системы, которая
описывается уравнением состояния (для одного
моля)
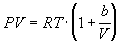
4. Давление пара (в Па) над твердым и жидким Cl2
выражается уравнениями
ln P(тв) = 29.209 – 3762.1/T
ln P(ж) = 13.763 – 1096.2/T
Рассчитайте температуру, давление и  плH(Cl2) в тройной
точке. плH(Cl2) в тройной
точке.
5. Для реакции
PCl5(газ) = PCl3(газ) + Cl2(газ)
 Go = –2508 Дж/моль при
250 oC. При каком общем давлении степень
разложения PCl5 при 250 o C составит 30%? Go = –2508 Дж/моль при
250 oC. При каком общем давлении степень
разложения PCl5 при 250 o C составит 30%?
6. Когда клетки скелетных мускулов лягушки
помещают в растворы NaCl различной концентрации, в
микроскоп можно наблюдать, что клетки остаются
неизменными в 0.7%-ном растворе, в более
концентрированных растворах они сморщиваются, в
менее концентрированных – набухают. Рассчитайте
равновесное давление на стенки клетки в чистой
воде при комнатной температуре.
7. Статистическая сумма некоторой
термодинамической системы, состоящей из N
одинаковых частиц равна:
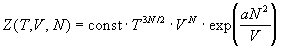 . .
Найдите энергию Гельмгольца и уравнение
состояния этой системы.
Биологический факультет
Экзамен по физической химии (3-й семестр)
1. Один моль дифторметана (идеальный газ), взятый
при 0 оС и 1 атм, нагрет при постоянном
давлении до утроения объема. Рассчитайте
изменение энтальпии, внутренней энергии и
энтропии в этом процессе, если теплоемкость
дифторметана зависит от температуры следующим
образом:
Cp = 20.26 + 7.59 10-2T
Дж/(моль. К). 10-2T
Дж/(моль. К).
2. Напишите выражение для бесконечно малого
изменения давления как функции энтальпии и
энтропии. Найдите частные производные давления
по этим переменным и составьте соответствующее
уравнение Максвелла.
3. Рассчитайте изменение энергии Гиббса в
результате испарения воды при 97 оС и 1 атм,
энтропия жидкой и газообразной воды при этой
температуре равна 87.0 и 186.3 Дж/(моль. К),
соответственно. При каком давлении изменение
энергии Гиббса в результате испарения воды будет
равно 0 при 97 оС?
4. Плотности жидкой и твердой ртути при
температуре плавления (–38.87oC) равны 13.690 и
14.193 г. см–3, соответственно.
Энтальпия плавления ртути равна 2.33 кал. г–1.
Определить температуру плавления ртути при
давлении 3000 атм.
5. Температура замерзания водного раствора
сахара равна –0.216 o С. Вычислите
осмотическое давление раствора при этой
температуре, если криоскопическая константа
воды KH2O = 1.86, а плотность раствора равна
1.01 г/мл.
6. Трехлитровый сосуд, содержащий 1.79 10–2 моль I2, нагрели до
973K. Давление в сосуде при равновесии оказалось
равно 0.49 атм. Считая газы идеальными, рассчитать
константу равновесия при 973 K для реакции 10–2 моль I2, нагрели до
973K. Давление в сосуде при равновесии оказалось
равно 0.49 атм. Считая газы идеальными, рассчитать
константу равновесия при 973 K для реакции
I2 (г) = 2I (г).
7. В некоторой молекуле есть два электронных
уровня энергии, отстоящие друг от друга на 1500 см–1.
Нижний уровень невырожден, верхний – трехкратно
вырожден. Найдите среднюю электронную энергию
молекулы (в см–1) при температуре 2000 К.
Значение постоянной hc/k = 1.44 см. К–1.
|

 .
.