|
Учебные материалы по физической химии
Задачи по физической химии.Часть 1.Химическая термодинамика
Список основных формул
I закон:
1) 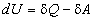
2)  U = Q – A U = Q – A
3) 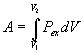
3а) 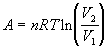 для обратимого
изотермического расширения идеального газа для обратимого
изотермического расширения идеального газа
4) 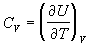
5) 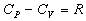 для одного моля
идеального газа для одного моля
идеального газа
6) 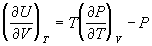
7) 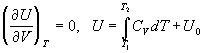 для одного
моля идеального газа для одного
моля идеального газа
8) H = U + PV,  H = H =  U + U +  (PV). (PV).
9) 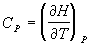
10) Закон Гесса: 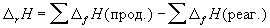 . .
11) Формула Кирхгофа: 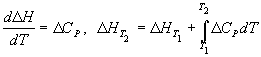
II закон
1) Термодинамическое определение энтропии: 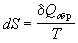 . .
2) Статистическое определение энтропии: 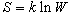 . .
3) Для идеального газа: 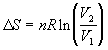 при изотерм. расширении при изотерм. расширении
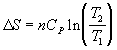 при нагревании при P
= const при нагревании при P
= const
 при нагревании при V
= const при нагревании при V
= const
4) Для фазовых переходов: 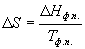
5) II закон: 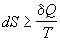 . .
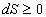 для изолированных
систем. для изолированных
систем.
6) Основное уравнение термодинамики: 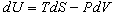 . .
7) Термодинамические потенциалы:
H = U + PV, dH = TdS + VdP
F = U – TS, dF = –SdT – PdV
G = H – TS, dG = VdP – SdT 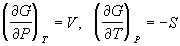
Для изотермических реакций: 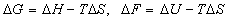
8) Соотношения Максвелла:
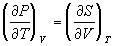 (равенство вторых
производных F) (равенство вторых
производных F)
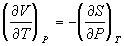 (равенство вторых
производных G) (равенство вторых
производных G)
9) Третий закон: 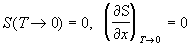 (x
= V, P). (x
= V, P).
Приложения термодинамики
I. Фазовые переходы индивидуальных
веществ
1) С = 2 + К – Ф
(С – число степеней свободы, К – число
компонентов, Ф – число фаз).
2) Уравнение Клапейрона: 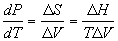
3) Уравнение Клапейрона-Клаузиуса: 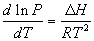 (для переходов в газовую фазу). (для переходов в газовую фазу).
Следствие: 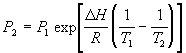
II. Смеси
1) Парциальные мольные величины: 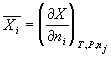
2) 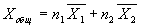
3) Уравнение Гиббса-Дюгема: 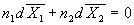 . .
4) Химический потенциал: 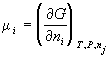 , , 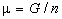 для
индивидуального вещества. для
индивидуального вещества.
5) 
6) Для идеального газа 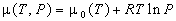 . .
7) Основные уравнения термодинамики для
открытых систем:
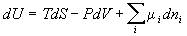
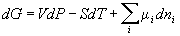
8) Идеальный раствор: 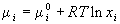
9) Закон Рауля (для растворителя): 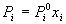
10) Закон Генри (для растворенного вещества): 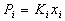
11) Понижение температуры замерзания: 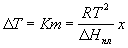
12) Повышение температуры кипения: 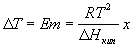
13) Осмотическое давление: 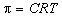 . .
III. Химическое равновесие aA + bB = cC
+ dD
1) 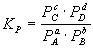 , , 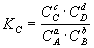 , , 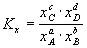
2) Для идеальных газов: 
3) Изотерма химической реакции:
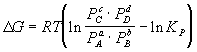 , , 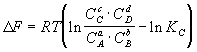
4) .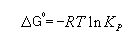
5) Изобара химической реакции: 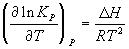 . .
Изохора химической реакции: 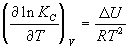 . .
Статистическая термодинамика
1) Распределение Больцмана: 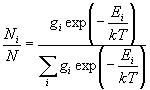
2) Распределение Максвелла: 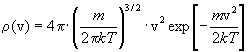
Средняя скорость: 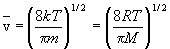
3) Сумма по состояниям: 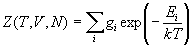
4) Связь суммы по состояниям с
термодинамическими функциями:
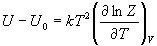
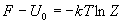
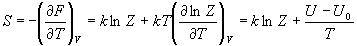
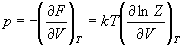
5) Молекулярные суммы по состояниям.
а) Поступательная: Qпост = 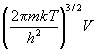
б) вращательная: Qвр = 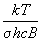 (для линейных молекул) (для линейных молекул)
в) колебательная: Qкол = 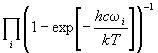
| 
