ПРИМЕРЫ РЕШЕНИЙ ВАРИАНТОВ ПИСЬМЕННОГО ЗАЧЕТА
Вариант 1

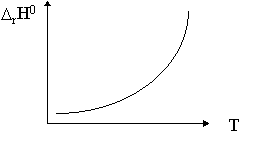
Согласно уравнению Кирхгофа [![]()
![]() rНo/
rНo/ ![]() Т] Р =
Т] Р = ![]()
![]() jCPj -
jCPj - ![]()
![]() iCPi >
0. Если суммы теплоемкостей для продуктов и
исходных веществ линейно зависят от температуры
(СР = а + b.Т), то зависимость
iCPi >
0. Если суммы теплоемкостей для продуктов и
исходных веществ линейно зависят от температуры
(СР = а + b.Т), то зависимость ![]() rНo
от температуры будет иметь вид восходящей
ветви параболы с минимумом при разности сумм
теплоемкостей равной нулю.
rНo
от температуры будет иметь вид восходящей
ветви параболы с минимумом при разности сумм
теплоемкостей равной нулю.

1-2 - изоэнтропийное сжатие (рост температуры);
2-3 - изотермическое расширение;
(рост энтропии);
3-1 - изобарное охлаждение, ![]() Т/
Т/![]() S)P = Т/СР
отражает наклон кривой.
S)P = Т/СР
отражает наклон кривой.
число молей |
2А |
+ |
В |
= |
С |
в исходной смеси |
2 |
1 |
0 |
||
в равновесной смеси |
2 - 2х |
1 - х |
х |
Суммарное число молей при равновесии: 2 - 2х + 1 - х + х = 3 -2х.
Парциальные давления: РС = хР/(3 - 2х); РА = (2 - 2х)Р/(3 - 2х); РВ = (1 - х)Р/(3 - 2х).
КР = РС/РА2РВ = х(3 - 2х)2/4(1 - х)3Р2.
(![]() ln КN/
ln КN/
![]() P)T = -
P)T = -
![]()
![]() / P = -
/ P = - ![]() V/ RT,
где
V/ RT,
где ![]()
![]() и
и ![]() V - изменение числа молей и
объема в ходе реакции соответственно. Для данной
реакции
V - изменение числа молей и
объема в ходе реакции соответственно. Для данной
реакции ![]()
![]() (
(![]() V) > 0 и, следовательно,
выход продуктов реакции падает при увеличении
общего давления в системе.
V) > 0 и, следовательно,
выход продуктов реакции падает при увеличении
общего давления в системе.
Восстановление: Cu+2 + 2e ![]() Cu
Cu
E = 0.337 - 0.268 + (RT/2F) ln a(Cu+2)![]() a(Cl-)2
a(Cl-)2
Вариант 8

На левом электроде (аноде) : 0.5 H2 - e = H+
Реакция в цепи: AgCl + 0.5 H2 = Ag + H+ + Cl- (все ионы в растворе)
При 298 K ![]() rG0 = - nFE0.
В данном случае
rG0 = - nFE0.
В данном случае
E0 = Е0 (Cl-
/ AgCl, Ag) = 0.222 В, а n = 1.Для
расчета ![]() rS0 и
rS0 и ![]() rН0 нужно
знать зависимость ЭДС от температуры, т.к.
rН0 нужно
знать зависимость ЭДС от температуры, т.к.![]() rS0 = nF(dE0/dT),
а
rS0 = nF(dE0/dT),
а ![]() rН0 =
rН0 =![]() rG0 + T
rG0 + T
![]() rS0.
rS0.
n = PV/RT моль. СР = (7/2)R, CV = (5/2)R,
![]() = CP/CV = 7/5 =1.4.
= CP/CV = 7/5 =1.4.
![]() - 1 = 0.4
T2 = T1(V1/V2)0.4 = 298(5/6)0.4 = 277 К.
- 1 = 0.4
T2 = T1(V1/V2)0.4 = 298(5/6)0.4 = 277 К.
![]() Т = T2 -
T1
Т = T2 -
T1![]() 0. A= -
0. A= - ![]() U> 0.
U> 0.
![]() U=nCV
U=nCV![]()
![]() T,
T, ![]() S=0
S=0
![]() F=
F= ![]() U - n S0(N2)
U - n S0(N2)![]() T.
T.
 fН
o для CO, So (298К) и СР (CP=
a+bT+cT2 +...) для С(графит), О2 и СО.
fН
o для CO, So (298К) и СР (CP=
a+bT+cT2 +...) для С(графит), О2 и СО. rНo(1000K)=
rНo(1000K)=![]() fНo(298)+
fНo(298)+![]()
![]()
 СPdТ.
СPdТ.
![]() Ср=
Ср=![]()
![]() j
СPj -
j
СPj - ![]()
![]() iСPi.
iСPi.
![]() rН(Р=2 атм, Т=1000 K)=
rН(Р=2 атм, Т=1000 K)= ![]() rНo(1000 K), так
как газы идеальные.
rНo(1000 K), так
как газы идеальные.
![]() rSo(1000 K)=
rSo(1000 K)= ![]() rSo(298)+
rSo(298)+
![]() (
(![]() СP/T)dТ.
СP/T)dТ.
![]() rS(P=2 атм,T=1000 K)=
rS(P=2 атм,T=1000 K)= ![]() rSo(1000 K)-
rSo(1000 K)-![]()
![]() Rln(2/1).
Rln(2/1).
![]()
![]() = 0.5.
= 0.5.
KP=Р(СО)/Р(О2)0.5. KP=(в+х)![]() Р0.5
(общ)/(а-0.5х)0.5
Р0.5
(общ)/(а-0.5х)0.5![]() (а+в+0.5х)0.5,
где а и в - начальные количества О2 и СО
(моль), соответственно.
(а+в+0.5х)0.5,
где а и в - начальные количества О2 и СО
(моль), соответственно.
Вариант 11
![]() fH&(CaV2O6)
=
fH&(CaV2O6)
= ![]() H1
+
H1
+ ![]() H2 +
H2 + ![]() H3
+
H3
+ ![]() H4
+
H4
+ ![]() H5
H5
![]() S=CPn1ln Т см/T1+ CPn2
lnТ см/Т2=
76.0(3000/18)ln(311/353) + 76.0(6000/18)ln(311/290)=
-1603.6+1770.8=167.2(Дж/К)
S=CPn1ln Т см/T1+ CPn2
lnТ см/Т2=
76.0(3000/18)ln(311/353) + 76.0(6000/18)ln(311/290)=
-1603.6+1770.8=167.2(Дж/К)
Вариант 15
2Li(тв) + S(ромб) + 2O2(г) = Li2SO4(тв)
Отрицательное значение энтальпии реакции соответствует экзотермической реакции, поскольку энтальпия системы в этом случае уменьшается (теплота выделяется во внешнюю среду).
![]() rG0 = - RTlnKP = - RT lnР (I2, г)
rG0 = - RTlnKP = - RT lnР (I2, г)
Стандартная энергия Гиббса рассчитывается по уравнению:
![]() rG0 =
rG0 =
![]() rH0 - T
rH0 - T
![]() rS0
rS0
где энтальпию и энтропию реакции при данной температуре можно рассчитать следующим образом:
![]() rH0
=
rH0
= ![]() rH0298
+
rH0298
+ ![]()
![]() rCР0dT
rCР0dT
![]() rS0
=
rS0
= ![]() rS0298
+
rS0298
+ ![]() T-1
T-1 ![]() rCР0dT
rCР0dT
При увеличении внешнего давления при
температуре 298 К ![]() rG > 0 и реакция
пойдет в обратном направлении, т.е. будет
образовываться I2 (тв).
rG > 0 и реакция
пойдет в обратном направлении, т.е. будет
образовываться I2 (тв).
x2= n2/(n1 + n2) = (m2/M2)/(m1/M1 + m2/M2)
Имеем одно уравнение с одним неизвестным - молярной массой
камфары, откуда находится искомая величина.
Порядком реакции называют сумму показателей степени в уравнении для скорости химической реакции:
w = k CAnA CBnB
Порядок реакции совпадает с молекулярностью в случае элементарной реакции. Для сложных реакции значение порядка может быть любым, в том числе дробным.