ВАРИАНТЫ ПИСЬМЕННОГО ЗАЧЕТА
Вариант 1
Изобразите зависимость теплового эффекта
реакции:
 1А1 +
1А1 +  2А2 + ...
2А2 + ...
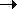
 1 'А1 ' +
1 'А1 ' +  2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
 iCPi) и продуктов (
iCPi) и продуктов (
 jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:
:
С 1 молем идеального газа реализован
обратимый цикл, приведенный на рисунке
(1-2 - адиабата, 2-3 -изотерма). Изобразите
указанный цикл в координатах S, T. Теоретически
обоснуйте свое решение.

Энергия Гиббса некоторого газа описывается
зависимостью G = U0 + CPT(1 - ln T) - TS0 + RTln P,
где U0, S0, CP - постоянные.
Найти уравнение состояния этого газа.
Выразите константу равновесия КР реакции
между идеальными газами А и В, взятыми в
стехиометрическом отношении: 2А + В = С,
обозначив через х. число молей образовавшегося
соединения С (газ), а через Р - равновесное
давление.
Газовая реакция А = 2В протекает в закрытой
системе до установления равновесия. Определите,
как будет меняться выход продуктов при
увеличении общего давления в системе.
Аргументируйте свой ответ.
Известны стандартные электродные потенциалы в
водных растворах при 25 0С: Е0 (Cu+2/ Cu) = + 0.337 В,
Е0 (Cl-/ Hg2Cl2, Hg) = 0.268 В.
Напишите окислительно-восстановительные
процессы, протекающие на электродах, а также
уравнение Нернста для расчета ЭДС обратимого
гальванического элемента, составленного из этих
электродов.
Для необратимой реакции произвольного n-го
порядка между соединениями, взятыми в
стехиометрическом отношении, определите (в общем
виде) время, за которое исходное вещество
превратится на 1/3 от начального количества.
Вариант 2
Изобразите зависимость теплового эффекта
реакции:
 1А1 +
1А1 +  2А2 + ...
2А2 + ...
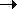
 1 'А1 ' +
1 'А1 ' +  2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
 iCPi) и продуктов (
iCPi) и продуктов (
 jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

С 1 молем идеального газа реализован
обратимый цикл, приведенный на рисунке
(2-3 - адиабата). Изобразите указанный цикл в
координатах S, T. Теоретически обоснуйте свое
решение.

Энергия Гельмгольца некоторого газа
описывается зависимостью F = U0 - TS0 + CVT(1 - lnT) - a/ (TV) - RTln(V - b), где
U0, S0, CV , a, b - постоянные.
Найти уравнение состояния этого газа.
Выразите константу равновесия КР реакции
между идеальными газами А и В, взятыми в
стехиометрическом отношении: А + B = 3С,
обозначив через х. число молей образовавшегося
соединения С (газ), а через Р - равновесное
давление.
Газовая реакция А + 2B = C + D
протекает в закрытой системе до установления
равновесия. Определите, как будет меняться выход
продуктов при увеличении общего давления в
системе. Аргументируйте свой ответ.
Известны стандартные электродные потенциалы в
водных растворах при 25 0С: Е0 (Cd+2/ Cd) = - 0.403 В,
Е0 (Hg+2/ Hg) = 0.769 В.
Напишите окислительно-восстановительные
процессы, протекающие на электродах, а также
уравнение Нернста для расчета ЭДС обратимого
гальванического элемента, составленного из этих
электродов.
Для необратимой реакции n-го порядка между
соединениями, взятыми в стехиометрическом
отношении, определите (в общем виде) время, за
которое исходное вещество превратится на 3/4 от
начального количества.
Вариант 3
Изобразите зависимость теплового эффекта
реакции:
 1А1 +
1А1 +  2А2 + ...
2А2 + ...
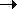
 1 'А1 ' +
1 'А1 ' +  2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
 iCPi) и продуктов (
iCPi) и продуктов (
 jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

С 1 молем идеального газа реализован
обратимый цикл, приведенный на рисунке
(2-3 - изотерма). Изобразите указанный цикл в
координатах S, T. Теоретически обоснуйте свое
решение.

Энергия Гельмгольца некоторого газа
описывается зависимостью F = U0 - TS0 + CVT(1 - lnT) - a/V - RTln(V - b), где
U0, S0, CV , a, b - постоянные.
Найти уравнение состояния этого газа.
Выразите константу равновесия КР реакции
между идеальными газами А и В, взятыми в
стехиометрическом отношении: А + B = 2С,
обозначив через х. число молей образовавшегося
соединения С (газ), а через Р - равновесное
давление.
Газовая реакция А + B = C протекает в
закрытой системе до установления равновесия.
Определите, как будет меняться выход продуктов
при увеличении общего давления в системе.
Аргументируйте свой ответ.
Известны стандартные электродные потенциалы в
водных растворах при 25 0С: Е0 (Fe+2/ Fe) = - 0.440 В,
Е0 (Cl- / AgCl, Ag) = 0.222 В.
Напишите окислительно-восстановительные
процессы, протекающие на электродах, а также
уравнение Нернста для расчета ЭДС обратимого
гальванического элемента, составленного из этих
электродов.
Для необратимой реакции n-го порядка между
соединениями, взятыми в стехиометрическом
отношении, определите (в общем виде) время, за
которое исходное вещество превратится на 1/4 от
начального количества.
Вариант 4
Изобразите зависимость теплового эффекта
реакции:
 1А1 +
1А1 +  2А2 + ...
2А2 + ...
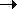
 1 'А1 ' +
1 'А1 ' +  2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
 iCPi) и продуктов (
iCPi) и продуктов (
 jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

Изобразите цикл Карно для 1 моля идеального
газа в координатах P, V и S, T. Теоретически
обоснуйте свое решение.

Энергия Гельмгольца некоторого газа
описывается зависимостью F = U0 - TS0 + CVT(1 - lnT) - RTln V,
где U0, S0, CV - постоянные.
Найти уравнение состояния этого газа.
Выразите константу равновесия КР реакции
между идеальными газами А и В, взятыми в
стехиометрическом отношении: А + B = С,
обозначив через х. число молей образовавшегося
соединения С (газ), а через Р - равновесное
давление.
Газовая реакция А + B = C + D
протекает в закрытой системе до установления
равновесия. Определите, как будет меняться выход
продуктов при увеличении общего давления в
системе. Аргументируйте свой ответ.
Известны стандартные электродные потенциалы в
водных растворах при 25 0С: Е0 (Zn+2/ Zn) = - 0.763 В,
Е0 (Cl-/ Hg2Cl2, Hg) = 0.268 В.
Напишите окислительно-восстановительные
процессы, протекающие на электродах, а также
уравнение Нернста для расчета ЭДС обратимого
гальванического элемента, составленного из этих
электродов.
Для необратимой реакции n-го порядка между
соединениями, взятыми в стехиометрическом
отношении, определите (в общем виде) время, за
которое исходное вещество превратится на 2/3 от
начального количества.
Вариант 5
Приведите различные формулировки и
математические выражения второго закона
термодинамики в дифференциальной и интегральной
формах.
Изобразите кинетические кривые для веществ А и
В в случае реакции первого порядка: А 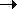 В. В какой системе
координат зависимость концентрации от времени
для исходного вещества линейна?.
Зависимость давления пара Р над жидким
веществом Д от температуры Т (К) описывается
следующим уравнением:
lg Р = А - В/ Т. Как рассчитать
В. В какой системе
координат зависимость концентрации от времени
для исходного вещества линейна?.
Зависимость давления пара Р над жидким
веществом Д от температуры Т (К) описывается
следующим уравнением:
lg Р = А - В/ Т. Как рассчитать  U и
U и  G в случае
испарения двух молей вещества Д? Какие допущения
Вы использовали?
Изобразите зависимости функций смешения
G в случае
испарения двух молей вещества Д? Какие допущения
Вы использовали?
Изобразите зависимости функций смешения  Н,
Н,  S,
S,  G,
G,  V от
состава идеального бинарного жидкого раствора
при температуре Т1. Как изменится вид этих
зависимостей, если температуру опыта увеличить?
Для электрохимической цепи:
V от
состава идеального бинарного жидкого раствора
при температуре Т1. Как изменится вид этих
зависимостей, если температуру опыта увеличить?
Для электрохимической цепи:
Cu | Zn| ZnSO4 (р-р) || CuSO4 (р-р)|Cu
написать реакции на электродах, реакцию в
электрохимической цепи. Показать, как, используя
стандартные электродные потенциалы, рассчитать
константу равновесия реакции при 298 K. В каком
направлении пойдет химическая реакция при
298 К, если активности ионов равны 1?
(Е0 (Zn+2/ Zn) = - 0.763 В, Е0 (Cu+2/ Cu) = 0.337 В).
В сосуде объемом 5 л при 25 0С и давлении 1
атм находится газ азот. При обратимом
адиабатическом расширении газа его температура
снизилась на 20 0С. Записать уравнения,
применяя которые можно рассчитать  Н и
Н и  G этого процесса,
если при 25 0С S0 (N2) = 45.77 э.е.
Указать выбранную Вами модель.
Как рассчитать
G этого процесса,
если при 25 0С S0 (N2) = 45.77 э.е.
Указать выбранную Вами модель.
Как рассчитать  U,
U,  Н и
Н и  S для реакции: С3Н6 + Н2 = С3Н8
при 500 К и 2 атм из стандартных справочных
данных? Газы считать идеальными.
S для реакции: С3Н6 + Н2 = С3Н8
при 500 К и 2 атм из стандартных справочных
данных? Газы считать идеальными.
Вариант 6
Приведите различные формулировки и
математические выражения третьего закона
термодинамики.
Получено вещество, которое кипит при 25 0С,
если давление равно 9 мм рт. ст. Как найти
нормальную точку кипения? Нужны ли для этого
дополнительные справочные данные?
Дана зависимость давления пара вещества 1 от
состава бинарного жидкого раствора при
постоянной температуре:
Покажите, как рассчитать коэффициент активности
вещества 1 при концентрации N1 при двух
различных способах стандартизации (в
симметричной и несимметричной системах
сравнения).
Изобразите кинетические кривые для веществ А и
В в случае реакции первого порядка: А 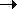 В, если начальная
концентрация В равно нулю. Каков физический
смысл абсциссы точки пересечения кривых?
Для электрохимической цепи:
В, если начальная
концентрация В равно нулю. Каков физический
смысл абсциссы точки пересечения кривых?
Для электрохимической цепи:
Cu | Zn| ZnSO4 (р-р)|| CuSO4 (р-р)|Cu
написать реакции на электродах, реакцию в
электрохимической цепи. Показать, как, используя
стандартные электродные потенциалы, рассчитать  rG
реакции при 298 K, если активности ионов равны
а (Zn+2) и а (Cu+2).
rG
реакции при 298 K, если активности ионов равны
а (Zn+2) и а (Cu+2).
(Е0 (Zn+2/ Zn) = - 0.763 В, Е0 (Cu+2/ Cu) = 0.337 В).
Записать уравнения, применяя которые можно
рассчитать теплоту, работу,  U,
U,  Н при обратимом
изотермическом расширении трех молей аргона,
если объем увеличивается в четыре раза,
температура 30 0С. Укажите выбранную Вами
модель.
Как вычислить
Н при обратимом
изотермическом расширении трех молей аргона,
если объем увеличивается в четыре раза,
температура 30 0С. Укажите выбранную Вами
модель.
Как вычислить  G и константу равновесия для
реакции: С (графит) + СО2 = 2СО
при 1000 К и 5 атм из стандартных справочных
данных? Газы считать идеальными.
G и константу равновесия для
реакции: С (графит) + СО2 = 2СО
при 1000 К и 5 атм из стандартных справочных
данных? Газы считать идеальными.
Вариант 7
Приведите формулировки и математические
выражения первого закона термодинамики в
интегральной и дифференциальной формах.
Изобразите цикл Карно в координатах
P = f (V), H = f (S).
Как рассчитать, при каком давлении температура
плавления льда понизится от 0 до -1 0С?
Нужны ли для этого дополнительные справочные
данные?
Время полупревращения вещества А по реакции
второго порядка при начальной концентрации А1
и температуре Т1 равно  (1/2)1, а при
температуре Т2 и той же начальной
концентрации А1 равно
(1/2)1, а при
температуре Т2 и той же начальной
концентрации А1 равно  (1/2)2. Определить,
будет ли время полупревращения при Т1
больше, меньше или равно времени полупревращения
при Т2 , если Т1
(1/2)2. Определить,
будет ли время полупревращения при Т1
больше, меньше или равно времени полупревращения
при Т2 , если Т1
 T 2. Ответ обосновать.
Для электрохимической цепи: Pt(H2)|HCl(р-р)| AgCl |
Ag | Pt написать реакции на электродах, реакцию в
электрохимической цепи. Показать, как, используя
стандартные электродные потенциалы, рассчитать
T 2. Ответ обосновать.
Для электрохимической цепи: Pt(H2)|HCl(р-р)| AgCl |
Ag | Pt написать реакции на электродах, реакцию в
электрохимической цепи. Показать, как, используя
стандартные электродные потенциалы, рассчитать  rG
реакции при 298 K, если средний ионный
коэффициент активности в растворе НCl с
концентрацией m равен
rG
реакции при 298 K, если средний ионный
коэффициент активности в растворе НCl с
концентрацией m равен 

(Е0 (Cl- / AgCl, Ag) = 0.222 В).
В сосуде при 25 0С и давлении 1 атм
находится 5.74 г газа азота. Записать уравнения,
применяя которые можно рассчитать  Т,
Т,  U и
U и  S, при обратимом
адиабатическом расширении газа до объема 6 л.
Укажите выбранную Вами модель.
Как вычислить
S, при обратимом
адиабатическом расширении газа до объема 6 л.
Укажите выбранную Вами модель.
Как вычислить  G и константу равновесия для
реакции: СаО (тв) + CО2 = СaCО3 (тв.)
при 1000 К и 3 атм из стандартных справочных
данных. Газ считать идеальным.
G и константу равновесия для
реакции: СаО (тв) + CО2 = СaCО3 (тв.)
при 1000 К и 3 атм из стандартных справочных
данных. Газ считать идеальным.
![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1 'А1 ' +
1 'А1 ' + ![]() 2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi) и продуктов (
iCPi) и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1 'А1 ' +
1 'А1 ' + ![]() 2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi) и продуктов (
iCPi) и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1 'А1 ' +
1 'А1 ' + ![]() 2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi) и продуктов (
iCPi) и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1 'А1 ' +
1 'А1 ' + ![]() 2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2 'А2 ' +...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi) и продуктов (
iCPi) и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:

