Решение варианта 1
1. Т (лед) = Т (вода, ж);
Р (лед) = Р (вода, ж); ![]() (лед) =
(лед) = ![]() (вода, ж).
(вода, ж).
2. 
3.
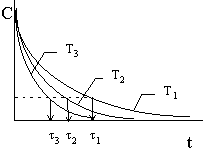
Для определения энергии активации ЕА
можно использовать зависимость времени
превращения одной и той же части вещества А,
например ![]() 1,
1, ![]() 2 и
2 и ![]() 3,
(начальные концентрации вещества А при всех Т
должны быть одинаковы, за исключением реакций
первого порядка) от температуры: ln
3,
(начальные концентрации вещества А при всех Т
должны быть одинаковы, за исключением реакций
первого порядка) от температуры: ln ![]() (1/n ) = А + В/Т, где А
постоянная, а В = ЕА/R.
(1/n ) = А + В/Т, где А
постоянная, а В = ЕА/R.
4. Используем уравнение изотермы химической
реакции:
![]() rG'0 =
rG'0 = ![]() rG0 + RT ln a H+;
rG0 + RT ln a H+;
RT ln a H+ = - 2.303. RT pH.
![]() rG0 =
rG0 = ![]() rG'0 + 2.303.
RT pH, где
rG'0 + 2.303.
RT pH, где ![]() rG0 -
стандартная энергия Гиббса реакции (в качестве
стандартного состояния выбрана единичная
концентрация в моль/л, т.е. все сi и
rG0 -
стандартная энергия Гиббса реакции (в качестве
стандартного состояния выбрана единичная
концентрация в моль/л, т.е. все сi и ![]() i равны 1).
i равны 1).  , где а - активности реагентов.
, где а - активности реагентов.
5. Например, Pt | Ag | AgCl | КCl (водный р-р) || КОН (водный р-р) | О2 | Pt
Реакция в электрохимической цепи:
0,5О2 + Н2О + 2Cl-
+ 2Ag = 2AgCl + 2ОН- , E0 = -
![]() rG0/nF = -
rG0/nF = - ![]() rG0/2F
rG0/2F
D rG0 = 2![]() fG0 (AgCl) + 2
fG0 (AgCl) + 2![]() fG0 (ОН- ) -
fG0 (ОН- ) - ![]() fG0 (Н2О) -
2
fG0 (Н2О) -
2![]() fG0 (Cl- ) ,
причем
fG0 (Cl- ) ,
причем
можно использовать ![]() fG0 при
298 К.
fG0 при
298 К.
6. ![]() = cRT (1), Pi = ciRT
(2). Нет, так как уравнение (1) выведено для малых
концентраций растворенного вещества и в
идеальных жидких растворах есть межмолекулярное
взаимодействие.
= cRT (1), Pi = ciRT
(2). Нет, так как уравнение (1) выведено для малых
концентраций растворенного вещества и в
идеальных жидких растворах есть межмолекулярное
взаимодействие.
7. ![]() rН0298 = 2
rН0298 = 2![]() fН0 (С2Н5ОН (ж)) + 2
fН0 (С2Н5ОН (ж)) + 2![]() fН0i (СО2) -
fН0i (СО2) -
![]() fН0i (С6Н12О6 (тв))
fН0i (С6Н12О6 (тв))
![]() rН0298 = -
66.33 кДж/моль. а) Если
rН0298 = -
66.33 кДж/моль. а) Если ![]() rН0 <
0, то константа равновесия уменьшится с
увеличением температуры согласно уравнению
изобары Вант-Гоффа:
rН0 <
0, то константа равновесия уменьшится с
увеличением температуры согласно уравнению
изобары Вант-Гоффа: 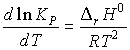 .
.
б) Давление не влияет на значение константы
равновесия: RT ln KP = - ![]() rG0.
rG0.
Решение варианта 2
1.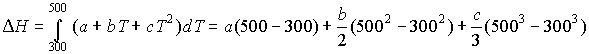

2. Экспериментально определяют теплоту
сгорания при постоянном объеме QV, причем QV = ![]() U . Реакция: С12Н22О11 (тв)+ 12О2 = 12СО2 + 11Н2О (ж)
U . Реакция: С12Н22О11 (тв)+ 12О2 = 12СО2 + 11Н2О (ж)
Для этой реакции ![]() U
U ![]()
![]() Н .
Н . ![]() сН0 -
энтальпия сгорания 1 моля вещества,
следовательно
сН0 -
энтальпия сгорания 1 моля вещества,
следовательно ![]() сН0 = (4 ккал/г).
М (г/моль), где М - молярная масса сахара.
сН0 = (4 ккал/г).
М (г/моль), где М - молярная масса сахара.
3. U = ![]() + TS - PV
+ TS - PV
4. Опытная энергия активации при низких температурах положительна, а при высоких температурах отрицательна. В случае ферментативных реакций увеличение температуры может приводить к денатурации фермента и, следовательно, к уменьшению эффективной константы скорости реакции.
5. Если считать, что соль полностью
диссоциирована, то ![]() = 2cRT,
следовательно с =
= 2cRT,
следовательно с = ![]() /2RT, причем
с - в моль/л.
/2RT, причем
с - в моль/л.
6. 1) Pt | СН3С(=О)Н, Н+, С2Н5ОН || НАД+, Н+, НАДН | Pt
2)  , где E'0 = Е'0 (1) -
Е'0 (2)
, где E'0 = Е'0 (1) -
Е'0 (2)
3) ln Ka = nFE'0/RT
4) ![]() при 298 К.
Рассчитав Е0, можно рассчитать
при 298 К.
Рассчитав Е0, можно рассчитать ![]() rG0 :
rG0 : ![]() rG0 = - nFE0 = -
2FE0.
rG0 = - nFE0 = -
2FE0.
7. Применяем уравнение изотермы химической реакции:
D rGР,Т = ![]() rG0Т + RT ln
rG0Т + RT ln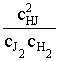 и
и ![]() rG0Т = -
RT ln KP. Для этой реакции КP = КC.
rG0Т = -
RT ln KP. Для этой реакции КP = КC.
1) ![]() rGР,Т = RT (ln 52/0.5.0.25 -
ln 50) = RT (ln 200 - ln 50) >
0, следовательно, образование HJ не пойдет.
rGР,Т = RT (ln 52/0.5.0.25 -
ln 50) = RT (ln 200 - ln 50) >
0, следовательно, образование HJ не пойдет.
2) ![]() rGР,Т = RT
(ln 102/2. 1 - ln 50) = RT
(ln 50 - ln 50) = 0, следовательно
система находится в равновесии и образование HJ
не пойдет.
rGР,Т = RT
(ln 102/2. 1 - ln 50) = RT
(ln 50 - ln 50) = 0, следовательно
система находится в равновесии и образование HJ
не пойдет.
Решение варианта 3
1. При использовании определения энергии
Гиббса G = U - TS + pV и уравнения,
обобщающего первый и второй законы
термодинамики dU = TdS - pdV можно получить
фундаментальное уравнение для энергии Гиббса dG =
- SdT + Vdp. Отсюда видно, что первая производная
энергии Гиббса по давлению равна: (dG/dp)T = V.
При интегрировании получаем искомую зависимость
G(Р2) = G(Р1) + ![]() Vdp.
В случае абсолютно твердого тела V = const и можно
записать G(Р2) = G(Р1) + V(Р2 - Р1).
Vdp.
В случае абсолютно твердого тела V = const и можно
записать G(Р2) = G(Р1) + V(Р2 - Р1).
2. Энергией Гиббса образования называют
изменение энергии Гиббса в реакции образования
одного моля данного вещества из простых веществ
в наиболее стабильной модификации при Р = 1 атм.
Для ее расчета необходимо знать энтальпию и
энтропию реакции образования, то есть, другими
словами, энтальпию и энтропию образования, ![]() fG =
fG = ![]() fH -
T
fH -
T ![]() fS. Энтальпию
образования можно определить из энтальпий
сгорания по известному соотношению,
fS. Энтальпию
образования можно определить из энтальпий
сгорания по известному соотношению, ![]() fH =
fH = ![]()
![]() cHi,ИСХОД -
cHi,ИСХОД -
![]()
![]() cHj,ПРОД. Энтропию
образования можно рассчитать из абсолютных
энтропий,
cHj,ПРОД. Энтропию
образования можно рассчитать из абсолютных
энтропий,
D fS = ![]() Si,ПРОД
-
Si,ПРОД
- ![]() Sj,ИСХОД.
Sj,ИСХОД.
3. Вначале рассчитаем стандартную энергию
Гиббса для реакции A' = A", ![]() rG0
= (
rG0
= (![]() fH0A" -
fH0A" - ![]() fH0A') - T (S0A"
- S0A') при данной температуре. Теперь
надо записать, каким образом энергия Гиббса
реакции зависит от давления. С использованием
результатов задачи N1 в приближении
независимости объема от давления можно записать
fH0A') - T (S0A"
- S0A') при данной температуре. Теперь
надо записать, каким образом энергия Гиббса
реакции зависит от давления. С использованием
результатов задачи N1 в приближении
независимости объема от давления можно записать ![]() rG(Р) =
rG(Р) = ![]() rG0
+
rG0
+ ![]() rV(Р - Р0). При
равновесии
rV(Р - Р0). При
равновесии ![]() rG должна быть
равна нулю. Отсюда получаем
rG должна быть
равна нулю. Отсюда получаем
p = p0 - ![]() rG0/
rG0/![]() rV,
rV, ![]() rV=М(1/
rV=М(1/![]() І -1/
І -1/![]() ў ), где М -
молярная масса вещества.
ў ), где М -
молярная масса вещества.
4. Согласно критерию равновесия химический
потенциал чистого растворителя при атмосферном
давлении должен быть равен химического
потенциалу растворителя в растворе при
повышенном давлении, ![]() 01
=
01
= ![]() 1(Р +
1(Р + ![]() ), где
), где ![]() - осмотическое давление. Можно
записать, что
- осмотическое давление. Можно
записать, что
m 1(Р + ![]() ) =
) = ![]() 01
+ RT ln a1 +
01
+ RT ln a1 + ![]()
![]() dР (где
dР (где ![]() - парциальный мольный объем растворителя
при заданной концентрации). Если концентрация
растворенного вещества невелика, то можно
приближенно принять парциальный мольный объем
растворителя равным мольному объему чистого
растворителя, и тогда мы получаем уравнение для
определения активности растворителя RT ln a1 = -
V
- парциальный мольный объем растворителя
при заданной концентрации). Если концентрация
растворенного вещества невелика, то можно
приближенно принять парциальный мольный объем
растворителя равным мольному объему чистого
растворителя, и тогда мы получаем уравнение для
определения активности растворителя RT ln a1 = -
V![]() . Активность растворенного
вещества можно определить по уравнению
Гиббса-Дюгема.
. Активность растворенного
вещества можно определить по уравнению
Гиббса-Дюгема.
5. Степень диссоциации газа связана с
константой равновесия реакции AB = A + B, KР = ![]() 2РОБЩ./{(1 +
2РОБЩ./{(1 + ![]() )(1 -
)(1 - ![]() )РСТАНД.}.
При увеличении температуры константа равновесия
меняется в соответствии с изобарой Вант-Гоффа
(d ln KР/dT) =
)РСТАНД.}.
При увеличении температуры константа равновесия
меняется в соответствии с изобарой Вант-Гоффа
(d ln KР/dT) = ![]() rH0/(RT2).
Энтальпия реакции диссоциации положительна,
следовательно константа равновесия будет
возрастать при увеличении температуры, а это в
свою очередь приведет к увеличению степени
диссоциации при постоянном давлении.
rH0/(RT2).
Энтальпия реакции диссоциации положительна,
следовательно константа равновесия будет
возрастать при увеличении температуры, а это в
свою очередь приведет к увеличению степени
диссоциации при постоянном давлении.
6. ЭДС элемента связана с энергией Гиббса
химической реакции по уравнению ![]() rG = - nEF, где F - число Фарадея,
а n - число переносимых электронов. В случае
записанной реакции n = 2. Можно записать, что E = -
rG = - nEF, где F - число Фарадея,
а n - число переносимых электронов. В случае
записанной реакции n = 2. Можно записать, что E = - ![]() rH/(nF) + T
rH/(nF) + T![]() rS/(nF). Тогда ЭДС при другой
температуре можно определить по уравнению E2
= E1 + (T2 - T1)
rS/(nF). Тогда ЭДС при другой
температуре можно определить по уравнению E2
= E1 + (T2 - T1) ![]() rS/(nF),
а энтропию реакции можно определить из данных
при температуре T1,
rS/(nF),
а энтропию реакции можно определить из данных
при температуре T1, ![]() rS
= (
rS
= (![]() rH + nE1F)/T1.
rH + nE1F)/T1.
7. Время полупревращения связано с константой скорости по уравнению:
t 1/2 = 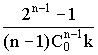 , где n -
порядок реакции, k - константа скорости, а Co -
начальная концентрация. Если можно считать, что 1)
порядок реакции не меняется с изменением
температуры (механизм реакции один и тот же),
, где n -
порядок реакции, k - константа скорости, а Co -
начальная концентрация. Если можно считать, что 1)
порядок реакции не меняется с изменением
температуры (механизм реакции один и тот же),
2) эксперименты проведены при одной и той же
начальной концентрации (Co = const), то мы
получаем, что при этих условиях ln k ~ - ln ![]() 1/2, и
1/2, и
EA = - RT2(d ln ![]() 1/2/dT)
соответственно.
1/2/dT)
соответственно.