ВАРИАНТЫ С РЕШЕНИЯМИ
Вариант 21
1. Предложите способ определения стандартной энтальпии образования глицина (тв).
2. Водород, взятый в количестве n молей при
температуре Т1, нагревается при постоянном
давлении Р = 1атм до температуры Т2. Найдите ![]() Н,
Н, ![]() S и
S и ![]() G в этом процессе, считая водород
идеальным газом. Нужны ли дополнительные
справочные данные для решения этой задачи?
G в этом процессе, считая водород
идеальным газом. Нужны ли дополнительные
справочные данные для решения этой задачи?
3. Зависимость давления насыщенного пара перфторорганического соединения, использующегося в качестве компонента искусственной крови, от температуры имеет вид: lg Р= а - b/Т - с lg T (Т, К; Р, Па), где а, b, с - постоянные. Найдите зависимость энтальпии и энтропии испарения этого соединения от температуры.
4. Стандартная энтальпия реакции гидрирования бензола при Т=298 К С6Н6 (г) + 3Н2 (г) = С6Н12 (г) равна 651,5 кДж/моль. Как объяснить, что промышленный синтез циклогексана проводят при высоких температуре и общем давлении в системе. Газы считать идеальными.
5. В бинарном жидком растворе давление насыщенного пара второго компонента равно Р02. Известно, что в области малых концентраций при мольной доле х2 < 0,05 зависимость давления пара этого вещества от х2 описывается законом Генри с константой К2. Найдите отношение коэффициентов активности вещества 2 в симметричной и несимметричной системах сравнения при х2 = 0,5. Изменится ли эта величина при изменении х2?
6. Предложите гальванический элемент, где протекает реакция
AgBr (тв) + 0,5Н2 (г) = Ag (тв) + НВr (водный р- р). Напишите реакции, протекающие на электродах. Как определить Е0 этого гальванического элемента.
7. Найдите отношение времен превращения исходного вещества на половину и на одну четвертую часть в реакции 2-го порядка.
Решение варианта 21
1. Экспериментально определяется ![]() сUT глицина в
кислороде (при повышенном давлении О2 для
обеспечения полноты сгорания), из этих данных
находят
сUT глицина в
кислороде (при повышенном давлении О2 для
обеспечения полноты сгорания), из этих данных
находят ![]() сU0T
сU0T
NH2CH2COOH (тв) + 2,25О2 (г) = 2СО2 (г) + 2,5Н2О (ж) + 0,5N2 (г),
![]() сН0Т =
сН0Т = ![]() сU0Т + 0,25? RT,
принимая, что газы идеальные,
сU0Т + 0,25? RT,
принимая, что газы идеальные,
![]() fH0Т (С2Н5О2N)
= -
fH0Т (С2Н5О2N)
= - ![]() cH0Т (С2Н4О2N)
+ 2
cH0Т (С2Н4О2N)
+ 2![]() fH0Т (CO2)
+ 2,5
fH0Т (CO2)
+ 2,5![]() fH0Т (H2O)
(ж).
fH0Т (H2O)
(ж).
2. ![]() H = nCР(T2- T1),
H = nCР(T2- T1),
![]() S = nCРln T2/T1,
S = nCРln T2/T1,
![]() G =
G = ![]() H -
H - ![]() (TS) =
(TS) = ![]() H - T2ST2
+ T1ST1 =
H - T2ST2
+ T1ST1 = ![]() H - T2(nS0T1
+
H - T2(nS0T1
+ ![]() S) + T1nS0T1.
S) + T1nS0T1.
Из справочника надо взять S0T1 для водорода и принять, что для водорода СP = 3,5R.
3. ![]() H = RT2(d ln P/dT)=2,303bR - cRT;
H = RT2(d ln P/dT)=2,303bR - cRT; ![]() S = RT(d lnP/dT) = 2,303bR/T - cR.
S = RT(d lnP/dT) = 2,303bR/T - cR.
4. (![]() ln KP/
ln KP/![]() T)P =
T)P = ![]() Н/RT2,
Н/RT2, ![]() Н > 0, с ростом
температуры выход циклогексана увеличится; (
Н > 0, с ростом
температуры выход циклогексана увеличится; (![]() ln KN/
ln KN/![]() P)T = -
P)T = -
![]() V/RT,
V/RT, ![]() V <
0, выход продукта с ростом общего давления в
системе увеличивается, если принять, что газы
идеальные.
V <
0, выход продукта с ростом общего давления в
системе увеличивается, если принять, что газы
идеальные.
5. ![]() 2 (сим) = P2/P02х2;
2 (сим) = P2/P02х2;
![]() 2 (несим) = P2/КГ2х2;
2 (несим) = P2/КГ2х2;
![]() 2 (сим)/
2 (сим)/![]() 2
(несим) = КГ2/Р02, от состава
раствора это соотношение не зависит.
2
(несим) = КГ2/Р02, от состава
раствора это соотношение не зависит.
6. Pt | H2 | НBr (водный р-р) | AgBr | Ag | Pt
На правом электроде: AgBr + e ![]() Ag + Br-
Ag + Br-
На левом электроде: 0,5Н2 - е ![]() Н+
Н+
![]()
![]() , рассматривая
зависимость
, рассматривая
зависимость ![]() от m
от m![]() 1/2,(m
1/2,(m![]() равна
моляльной концентрации m раствора НВr), при m
равна
моляльной концентрации m раствора НВr), при m ![]() 0,
0, ![]()
![]()
![]() 1, получаем значение Е0.
1, получаем значение Е0.
7. Время превращения вещества на долю ![]() = C/C0 равно:
= C/C0 равно:
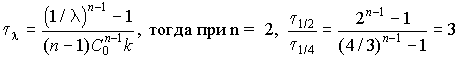 .
.