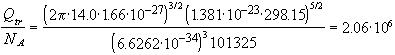
Вариант 22
1. 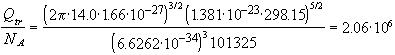
F = -RT ln(Qtr/NA) - RT = -38517 Дж/моль
G = F + PV = F + RT = -36038 Дж/моль
U = (3/2)RT = 3718 Дж/моль
H = (5/2)RT = 6197 Дж/моль
S = R ln(Qtr/NA) + (5/2)R = 142 Дж/(моль. K)
2. Для газа Больцмана среднее число молекул в состоянии i дается выражением:
Ni = gi exp[(![]() -
- ![]() i)/kT].
i)/kT].
Следовательно, N0 = g0 exp(![]() /kT), N1 = g1
exp[(
/kT), N1 = g1
exp[(![]() - E)/kT],
- E)/kT],
N = N0 + N1 = g0
exp(![]() /kT) + g1 exp[(
/kT) + g1 exp[(![]() - E)/kT] = exp(
- E)/kT] = exp(![]() /kT) [g0 + g1 exp(-E/kT)],
/kT) [g0 + g1 exp(-E/kT)],
exp(![]() /kT) = N[g0
+ g1 exp(- E/kT)]-1.
/kT) = N[g0
+ g1 exp(- E/kT)]-1.
Следовательно,
N0 = g0N [g0 + g1 exp(-E/kT)]-1,
N1 = g1N exp(-E/kT) [g0 + g1 exp(- E/kT)]-1
Для внутренней энергии <E> получаем выражение:
<E> = Eg1N exp(-E/kT) [g0 + g1 exp(-E/kT)]-1,
а для теплоемкости - соотношение:
C = (g0g1NE2/kT2) exp(-E/kT) [g0 + g1 exp(-E/kT)]-2.
3. 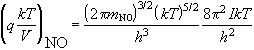


![]() кДж/моль
кДж/моль

![]()
![]()
lnKp = -11.77 + 75391/T - (3/2)lnT
lnKp(298) = 233
![]() G0
= -RT lnKp = 97.9T - 626800 + 12.5T lnT
G0
= -RT lnKp = 97.9T - 626800 + 12.5T lnT
![]() G0(298)
= -576404 Дж/моль
G0(298)
= -576404 Дж/моль
![]() S0
= -(
S0
= -( ![]()
![]() G/
G/![]() T)p = -97.9 - 12.5lnT - 12.5 =
-110.4 - 12.5lnT
T)p = -97.9 - 12.5lnT - 12.5 =
-110.4 - 12.5lnT
![]() S0(298)
= -181.6 Дж/(моль. К)
S0(298)
= -181.6 Дж/(моль. К)
![]() H0
=
H0
=![]() G
+ T
G
+ T![]() S = -626800 - 12.5T
S = -626800 - 12.5T
![]() H0(298)
= -630525 Дж/моль
H0(298)
= -630525 Дж/моль