34ая Международная Химическая
Олимпиада
Гронинген, среда, 10 июля 2002 г.
Задание теоретического тура
Химия и качество жизни идут рука об
руку.
Тема I Химия живого
I-1 Кислород и жизнь.
I-2 Азот в природе.
Тема II Химия в промышленности.
II-1 Инулин – новое возобновляемое природное
сырье.
II-2 Производство метанола.
II-3 Арамиды – высокоэффективные полимерные
материалы.
Тема III Химия природных соединений.
III-1 Фосфолипиды в мембранах.
III-2 Глутатион – важный природный олигопептид.
Тема IV Свет и энергия: химические аспекты.
IV-1 Лампы освещения.
IV-2 Красный рубин.
IV-3 Аккумуляторы для транспорта.
- Впишите свою фамилию и личный код
(проставленный на вашем рабочем месте) в
соответствующем месте каждого листа.
- Вам выделяется 5 часов на выполнение всех
задач и запись результатов в листы ответов. После
подачи команды СТОП вы обязаны немедленно
прекратить работу. Задержка в выполнении этого
требования на 3 минуты приведет к аннулированию
текущей задачи и нулевому результату за нее.
- Все результаты должны быть вписаны в
соответствующие места на листах ответов.
Результаты, записанные в других местах, не будут
оцениваться. Не пишите ничего на обратной
стороне листов ответов. Если вам необходима
писчая бумага для работы или требуется заменить
испорченный лист ответа, попросите их у
ассистента.
- При необходимости выйти в туалет, следует
спросить разрешения.
- После окончания работы вы должны поместить все
бумаги в выданный вам конверт и заклеить его.
Проверяться и оцениваться будут только листы из
этого конверта.
- Вам будет выдана квитанция за сданный
заклеенный конверт. Не покидайте комнаты в
которой вы выполняли задание до тех пор, пока вы
не получите квитанцию.
- Используйте только принадлежности и
калькулятор, которые были выданы вам.
- Периодическая система элементов прилагается в
конце задания.
- Данное задание включает 36 листов.
- Официальная английская версия текста задания
будет вам выдана, если вы попросите.
Тема 1. ХИМИЯ И ЖИЗНЬ
Жизнь подчиняется химическим законам.
Соответственно, в химии уделяется большое
внимание изучению процессов, протекающих в живой
материи.
Задача I-1. КИСЛОРОД В ВАШЕЙ ЖИЗНИ
6 баллов
|
1 |
2 |
3 |
4 |
5 |
| Очки |
25 |
25 |
15 |
25 |
10 |
Кислород жизненно важен для всех нас. Кислород
попадает в организм через легкие и переносится
кровью в ткани (мышцы), где может производить
энергию, окисляя сахара:
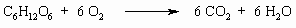
В данной реакции выделяется 400 кДж энергии на
один моль кислорода. Кровь поглощает O2
благодаря четырем группам гема (Hm), входящим в
состав белка гемоглобина (Hb).
Свободный Hm состоит из иона Fe2+, связанного
с 4 атомами азота лиганда порфирин2-.
Кислород может связываться с Fe2+, образуя
комплекс Hm. O2. Монооксид углерода
может связываться аналогично, образуя при этом
комплекс Hm. CO. Монооксид углерода CO
является ядом, поскольку связывается с Hm прочнее,
чем O2. Константа равновесия K1 для
реакции:
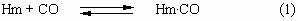
в 104 раз больше, чем константа равновесия K2
для реакции:
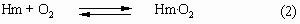
Каждая молекула Hb может максимально связать 4
молекулы O2. Кровь, контактирующая с O2,
поглощает его. Доля Hb, связанного с кислородом,
зависит от давления кислорода, как показано на
рис. 1 (кривая (1)). Также на рис. 1 приведены кривые
(2) и (3) для крови, содержащей дефектные Hb. Такие
дефекты встречаются у пациентов с
наследственными заболеваниями.

Рис 1.
Данные, необходимые для решения задачи:
давление O2 в легких 15 кПа; давление O2
в мышцах 2 кПа. Поток крови через сердце и легкие 4.
10–4 м3. с–1. Красные
кровяные тельцах занимают 40% объема крови; внутри
красных кровяных телец концентрация Hb
составляет 340 кг м–3; молярная масса Hb 64 кг.
моль–1. R = 8,314 Дж.моль–1. K–1. T
= 298 K.
I-1-1 Используя соотношение между константой
равновесия K и стандартной энергией Гиббса
реакции  G0,
рассчитайте разницу между значениями
G0,
рассчитайте разницу между значениями  G0 для реакций (1) и (2).
G0 для реакций (1) и (2).
Ответ дан в формате PDF
Ваши вычисления:
I-1-2 Используя рис. 1, рассчитайте (точность 2
значащие цифры), сколько молей O2 попадет в
мышцы при переходе одного моля Hb из легких в
мышцы. Приведите расчеты для трех типов Hb (см. рис.
1).
Hb (1):
Hb (2):
Hb (3):
I-1-3 Кривая (1) имеет S-образную форму благодаря
особенностям структуры Hb. Дефектный Hb,
описываемый кривой (2), не оптимален для
транспорта кислорода, потому что:
- Он связывается с O2 слишком слабо.
- Он связывается с O2 слишком сильно.
- Его максимальная емкость по кислороду слишком
низкая.
- Дефектность обусловлена отравлением Hb
монооксидом углерода.
Отметьте правильный ответ крестиком.
I-1-4 Рассчитайте, сколько кислорода (в моль.с–1)
может быть доставлено в мышцы кровью, содержащей
нормальный Hb типа (1).
Ответ дан в формате PDF
Ваши вычисления:
I-1-5 Рассчитайте максимальную мощность,
которую может произвести тело человека при
условии, что процесс лимитируется переносом
кислорода.
Ответ дан в формате PDF
Ваши вычисления:
Задача I-2. АЗОТ В ПРИРОДЕ
7 баллов
|
1 |
2 |
3 |
4 |
5 |
| Очки |
15 |
15 |
20 |
25 |
25 |
Аммиак токсичен для морских животных при
концентрации, превышающей 1 ppm. Нитрифицирующие
бактерии играют важную роль в процессе
превращения NH3 сначала в нитрит, а затем в
нитрат, являющийся основной формой нахождения
азота в почве.
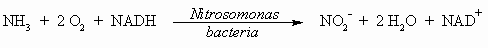
NADH является восстановленной формой кофермента
никотинамиддинуклеотида (NAD), а NAD+ является
окисленной формой кофермента NAD.
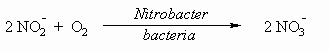
I-2-1 В квадратиках под соответствующей
формулой укажите степень окисления азота для
каждого из веществ:

Спектрофотометрическое определение нитрита
основано на его реакции с индикатором.
Получающийся окрашенный продукт имеет максимум
поглощения при  = 543 нм.
= 543 нм.
Для количественного анализа должна быть
построена калибровочная кривая зависимости
оптической плотности при  = 543
нм от концентрации нитрита.
= 543
нм от концентрации нитрита.
I-2-2 Измерения проводятся при длине волны,
соответствующей максимуму поглощения потому,
что:
- отсутствует влияние примесей
- отсутствует влияние рассеянного света
- достигается оптимальная точность измерения
- неверно ни одно из вышеприведенных утверждений
Отметьте правильный ответ галочкой.
Оптическая плотность измеряется в однолучевом
спектрофотометре. Однако при этом 5% света (так
называемый рассеянный свет Is)
непосредственно попадает в детектор (см. рис. 2).

Рис 2.
1-2-3 Рассчитайте значение оптической
плотности A, которую покажет описанный выше
спектрофотометр, если  = 6000 M–1.
cм–1, l = 1 cм и c = 1. 10–4 M
= 6000 M–1.
cм–1, l = 1 cм и c = 1. 10–4 M
Ответ дан в формате PDF
Ваши вычисления:
В эксперименте по определению нитритного азота
в воде были получены следующие данные.
Концентрация
нитритного азота (ppm) |
Оптическая плотность
при 543 нм
(1.000 cм кювета) |
|
Холостой опыт
|
0.003 (поглощение примесей в растворителе)
|
0.915 |
0.167 |
1.830 |
0.328 |
I-2-4 Учитывая поправку на холостой опыт,
определите из табличных данных значения m и b
для калибровочной прямой A = m. c + b.
Ответ дан в формате PDF
Ваши вычисления m:
Ваши вычисления b:
Результаты двух измерений одного и того же
образца воды приведены ниже. Измерения были
проведены при 543 нм в кювете с длиной оптического
пути 2.000 см.
| |
Оптическая плотность |
| измерение 1 |
0.562 |
| измерение 2 |
0.554 |
Для расчета концентрации нитритного
азота, c (в ppm), в этом эксперименте методом
наименьших квадратов было получено уравнение
Оптическая плотность с поправкой = 0.1769 c +
0.00150 которое применимо для кювет с длиной
оптического пути 1.000 см.
I-2-5 Рассчитайте среднюю концентрацию
нитритного азота в ppm и в мкг.мл-1. (Учтите
поправку на холостой опыт из первой таблицы).
Ответ дан в формате PDF
Ваши вычисления
Тема II. ХИМИЯ В ПРОМЫШЛЕННОСТИ
В повседневной жизни мы используем
многие продукты, которые производят в
промышленном масштабе.
Задача II-1. ИНУЛИН - НОВОЕ ВОЗОБНОВЛЯЕМОЕ
ПРИРОДНОЕ СЫРЬЕ
6 баллов
|
1 |
2 |
3 |
4 |
5 |
| очки |
15 |
15 |
30 |
10 |
30 |
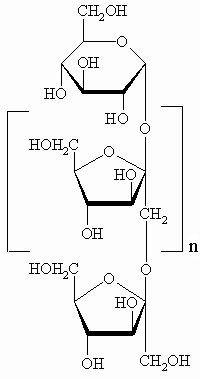
Инулин, который производят из корней цикория в
Бельгии и Нидерландах, используют как пищевую
добавку, так как он полезен для кишечной флоры. Он
используется также как источник фруктозы,
которая в 1.9 раза слаще сахарозы, и для
производства маннита, применяющегося в
жевательной резинке. Инулин – линейный полимер
из фрагментов фруктозы с глюкозой на одном из
концов. Проекция Хеуорса для инулина показана
слева. В этой задаче инулин содержит 10 фрагментов
фруктозы (n = 9).
II-1-1 Инулин может быть прогидролизован в
условиях H+-катализа. Ниже приведены 4
механизма разрыва C-O связи (A, B, C и D).
Отметьте крестиком правильный механизм для
наиболее эффективного гидролиза.
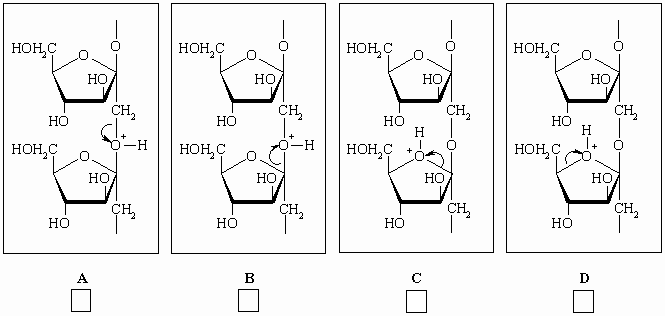
Гидролиз с использованием изотопно меченой
воды может дать информацию о механизме реакции.
Для этого используется современные методы ЯМР,
которые могут "видеть" как дейтерий (2H),
так и изотоп кислорода 17O.
II-1-2 Какая меченая вода может лучше всего
использоваться для этой цели?
Отметьте правильный ответ.
- 2
H217O
- Ни один из вариантов.
При каталитическом гидрировании глюкоза дает
сорбит (S), в то время как фруктоза (F) дает и
маннит (M), и сорбит (S).
II-1-3 Нарисуйте проекции Фишера для фруктозы (F),
сорбита (S) и маннита (M).

К 1.00 моль инулина в 2.00 кг воды добавляют
катализатор и при 95 оС одновременно
проводят гидролиз и гидрирование. Селективность
гидрирования фруктозы в маннит/сорбит
составляет
7/3.
II-1-4 Сколько молей маннита и сорбита
образуется?

После завершения реакции катализатор удаляют и
реакционную смесь охлаждают до 25 oC.
Растворимость M в воде составляет 0.40 моль.
кг–1 при 25 oC, а растворимость S
настолько велика, что он не выпадает в осадок.
II-1-5 Рассчитайте, сколько молей M выпадет в
осадок.
Ваши ответы и расчеты:



